ARTÍCULO ORIGINAL
Estudio químico de los compuestos lipídicos de las hojas, tallos y flores de Vernonanthura patens (Kunth) H. Rob. (Asteraceae)
Chemical study of lipid compounds from leaves, stems and flowers of Vernonanthura patens (Kunth) H. Rob. (Asteraceae)
MSc. Patricia Manzano Santana,I Dra. C. Migdalia Miranda Martínez,II MSc. Rodney Montes de Oca Porto,III QF. Tulio Orellana León,I Dr. C. Juan Abreu Payrol,II Dra. C. Esther L. Peralta GarcíaI
I Escuela Superior Politécnica
del Litoral. Guayaquil-Ecuador.
II Universidad de La Habana.
La Habana. Cuba.
III Instituto de Medicina del
Deporte. La Habana, Cuba.
Introducción: Vernonanthura
patens (Kunth) H. Rob. es una especie que crece silvestre en el Ecuador,
para la cual existen escasos antecedentes de estudios químicos y biológicos,
y en ninguno de estos se aborda el estudio de fracciones lipídicas.
Objetivos: estudiar las fracciones de compuestos lipídicos presentes
en las hojas, tallos y flores de la especie.
Métodos: la planta se recolectó en estado adulto, en época
de floración, los órganos vegetales fueron secados en estufa por
separado, se molinaron hasta tamaño de partícula 2 mm y se extrajeron
por maceración con etanol. Los extractos etanólicos concentrados
se separaron por columna cromatográfica, las fracciones lipídicas
separadas con hexano fueron saponificadas y analizadas por el sistema acoplado
de cromatografía gaseosa-espectrometría de masas.
Resultados: se identificaron los ácidos grasos y compuestos insaponificables
presentes en los órganos estudiados, encontrándose algunas diferencias
de composición entre estos.
Conclusiones: se identificaron 29 ácidos grasos y 8 compuestos insaponificables
presentes en los órganos vegetales estudiados.
Palabras clave: Vernonanthura patens, ácidos grasos, compuestos insaponificables, estudio químico.
Introduction: Vernonanthura patens
(Kunth) H. Rob. is a species that grows wild in Ecuador. Few chemical and biological
studies have been conducted on this species, and none of them deal with lipid
fractions.
Objectives: study the fractions of lipid compounds present in the leaves,
stems and flowers of the species.
Methods: the plant was collected in its adult stage, during the flowering
season. Plant organs were oven dried separately, ground to 2 mm particle size,
and extracted by maceration with ethanol. The concentrated ethanolic extracts
were separated by column chromatography. Lipid fractions were separated with
hexane, and then saponified and analyzed by coupled gas chromatography mass
spectrometry.
Results: identification of the fatty acids and unsaponifiable compounds
present in the organs studied revealed some differences in their composition.
Conclusions: 29 fatty acids and 8 unsaponifiable compounds were identified
in the plant organs studied.
Key words: Vernonanthura patens, fatty acids, unsaponifiable compounds, chemical study.
INTRODUCCIÓN
La especie Vernonanthura patens es originaria de México y Suramérica, encontrándose distribuida en México, Belice, Costa Rica, El Salvador, Guatemala, Honduras, Nicaragua, Panamá, Venezuela, Bolivia, Colombia, Ecuador y Perú.1-4
En el Ecuador, la utilizan para lavar heridas en humanos y animales por su poder cicatrizante y antimicrobiano, para el dolor de cabeza por su acción analgésica, como antiinflamatoria, para calmar la tos, para combatir el pie de atleta, en el tratamiento de leishmaniasis y para combatir ciertos tipos de cáncer.5-7
A pesar de la complejidad de componentes informados para el género, para la especie V. patens en particular existe escasa información. La primera indagación que se recoge sobre la composición química de la especie data de 1975, donde solo se señala la ausencia de lactonas sesquiterpénicas en la especie, las cuales constituían un marcador químico del género.8 Sin embargo, en 1986 se identifican 10 compuestos, entre los que se incluyen lactonas sesquiterpénicas;9 estos constituyen los únicos reportes anteriores sobre la composición química de la especie y ninguno de ellos de la que crece en Ecuador.
Teniendo en cuenta estos antecedentes es que se planteó en este trabajo como objetivo el estudio químico de las fracciones lipídicas de las hojas, tallos y flores de la especie.
MÉTODOS
Se trabajó con hojas, tallos y flores, de plantas adultas de Vernonanthura patens (laritaco) en estado fenológico de floración, recolectadas en Marcabelí, provincia del Oro, Ecuador, y herborizadas en el Herbario Nacional del Ecuador QCNE Quito, con clave CIBE37.
El material vegetal se secó de forma independiente, en estufa con recirculación de aire a temperatura de 45 °C hasta peso constante; una vez seco, cada órgano vegetal por separado se pulverizó en un molino de cuchillas y se tamizó a tamaño de partícula de 2 mm de diámetro, según lo recomendado en las normas internacionales.10,11
La extracción se llevó a cabo por separado, por maceración múltiple con etanol (10 volúmenes de etanol/kg de droga), en recipiente cerrado, ausencia de luz y con agitación en una zaranda New Brunswick Scientific modelo C-10. El tiempo de extracción fue de 8 días para cada maceración hasta total agotamiento del material vegetal después de 3 maceraciones. Los extractos obtenidos se reunieron y filtraron empleando papel filtro, luego se concentraron a sequedad en un evaporador rotatorio marca Heidolph modelo Laborota 4001 a presión reducida y a 50 °C. Los residuos secos obtenidos se guardaron en frasco de vidrio ámbar en refrigeración a 4 °C, hasta su separación.
Los residuos secos de los extractos de las hojas (H), tallos (T) y flores (F) fueron sometidos de forma independiente, a fraccionamientos en columnas cromatográficas de 80 cm de largo y 4,5 cm de diámetro, empaquetadas con sílice activada de 60-200 mesh, en proporción 3:1 respecto al peso del residuo a separar, el cual fue previamente adsorbido en gel de sílice, secado en corriente de aire y colocado en la parte superior de la columna. La elución se realizó a presión atmosférica, con disolventes de grado analítico Merck en orden creciente de polaridad, comenzando con hexano.
Con el disolvente hexano 100 % se obtuvieron diferentes fracciones, que por su aspecto grasoso o ceroso fueron reunidas. En el caso de las hojas, las fracciones reunidas, 5 y 6, presentaron un color naranja intenso que posteriormente y de forma espontánea se separó en 2 fracciones, una cera blanca y una naranja, que fueron apartadas de forma mecánica y analizada de forma independiente. Estas fracciones, así como las de tallos (1-19) y flores (31-41), se sometieron a proceso de saponificación con NaOH 1 N durante 2 h, posteriormente, se separaron los ácidos grasos de los compuestos insaponificables, siguiendo el procedimiento descrito por Beyer y Walter.12
Las fracciones de los ácidos grasos se metilaron, como paso previo a la caracterización por CG-EM (cromatografía gaseosa-espectrometría de masa). Por cada 20 mg de fracción se utilizaron 50 µL de yoduro de metilo, 100 µL de acetona y 50 mg de carbonato de potasio, incubándose a 60 °C por 3 h.
Las fracciones de los compuestos saponificables e insaponificables se analizaron en un cromatógrafo de gases Agilent 6890 acoplado a espectrómetro de masas 5973N, con las condiciones de trabajo siguientes: columna Ultra 2 de 12 m x 0,20 mm x 0,33 µm, temperatura inicial: 60 °C por 3 min, incrementando 10 °C/min hasta 300 °C por 5 min. Tiempo de corrida: 32 min. Espectrómetro de masas operado a 70 eV en modo Full Scan desde 50 hasta 600 unidades de masa. Temperatura de la fuente 230 °C, temperatura del cuadrupolo 150 °C. Temperatura del inyector: 280 °C, volumen de inyección 2 µL con gas portador helio a 1 mL/min.
Las asignaciones de las estructuras se efectuaron por comparación de los espectros de masa de los compuestos con los de la base de datos del equipo, seleccionando aquellos que sobrepasaban 90 % de confiabilidad.
RESULTADOS
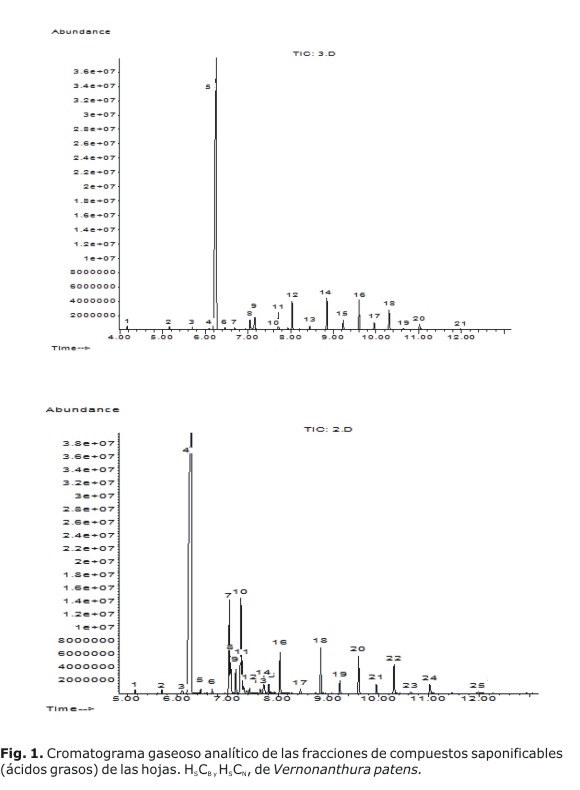
Los cromatogramas gaseosos de las fracciones de los ácidos grasos metilados de las hojas (cera blanca [HSCB] y naranja [HSCN]), se presentan en la figura 1; en la figura 2 se exponen los cromatogramas gaseosos de los ácidos grasos metilados de los tallos y las flores. En la tabla 1 se presentan los compuestos que se identificaron por análisis de sus espectros de masas y comparación de estos con la base de datos del equipo, así como sus tiempos de retención y abundancia relativa.
Tabla
1. Análisis comparativo
de los compuestos identificados en las fracciones
de ácidos grasos de hojas, tallos y flores de Vernonanthura patens
|
Compuesto |
Porcentaje de abundancia relativa |
||||
|
HSCB |
HSCN |
TSC |
FSC |
||
|
1 |
Dimetil-éster del ácido nonanodioico |
0,37 |
- |
0,01 |
- |
|
2 |
Ácido tetradecanoico |
0,31 |
0,26 |
0,03 |
0,23 |
|
3 |
Ácido pentadecanoico |
0,31 |
0,24 |
0,06 |
0,15 |
|
4 |
Ácido 9-hexadecenoico (isóm) |
0,33 |
0,45 |
0,04 |
- |
|
5 |
Ácido hexadecanoico |
74,24 |
57,74 |
13,31 |
47,50 |
|
6 |
Etil éster del ácido hexadecanoico |
- |
- |
- |
0,26 |
|
7 |
Ácido (Z)-9-hexadecenoico |
0,22 |
- |
- |
- |
|
8 |
Ácido 2-hexadecenoico |
- |
0,29 |
- |
- |
|
9 |
Ácido heptadecanoico |
0,21 |
0,27 |
0,06 |
0,11 |
|
10 |
Ácido 8,11-octadecadienoico |
- |
- |
- |
7,52 |
|
11 |
Ácido 7, 8,11-octadecatrienoico |
- |
6,1 |
- |
- |
|
12 |
Ácido 11-octadecenoico |
1,15 |
2,6 |
- |
- |
|
13 |
Ácido 8-octadecenoico |
- |
- |
0,40 |
- |
|
14 |
Ácido octadecanoico |
2,36 |
1,71 |
0,43 |
1,32 |
|
15 |
Ácido nonadecanoico |
0,05 |
- |
- |
- |
|
16 |
Ácido 9,12-octadecadienoico |
- |
1,82 |
1,41 |
0,56 |
|
17 |
Ácido 9,11-octadecadienoico |
- |
0,33 |
0,18 |
- |
|
18 |
Ácido 9,12,15-octadecatrienoico |
- |
0,31 |
- |
2,14 |
|
19 |
Ácido 9,13,15-octadecatrienoico |
- |
0,72 |
- |
|
|
20 |
Ácido eicosanoico |
3,26 |
2,66 |
0,17 |
0,88 |
|
21 |
Ácido heneicosanoico |
0,38 |
0,34 |
- |
- |
|
22 |
Ácido docosanoico |
3,86 |
2,88 |
0,40 |
3,70 |
|
23 |
Ácido tricosanoico |
1,2 |
0,90 |
0,11 |
0,56 |
|
24 |
Ácido tetracosanoico |
3,69 |
2,70 |
0,54 |
7,24 |
|
25 |
Ácido pentacosanoico |
0,93 |
0,71 |
0,11 |
0,46 |
|
26 |
Ácido hexacosanoico |
2,79 |
2,17 |
0,95 |
7,32 |
|
27 |
Ácido heptacosanoico |
0,24 |
0,17 |
- |
0,19 |
|
28 |
Ácido octacosanoico |
0,87 |
0,89 |
0,79 |
2,25 |
|
29 |
Ácido triacontanoico |
0,10 |
0,33 |
0,37 |
0,47 |
HSCB: fracción saponificable hojas cera blanca, HSCN:
fracción saponificable hojas cera naranja,
TSC: fracción saponificable cera de tallos, FSC: fracción saponificable
cera de flores.
Para los compuestos insaponificables, los cromatogramas gaseosos se presentan en la figura 3 (hojas, tallos y flores), y la relación de compuestos identificados en la tabla 2.
DISCUSIÓN
Los cromatogramas gaseosos de las fracciones de los ácidos grasos metilados de las hojas, cera blanca (HSCB) y naranja (HSCN), se presentan en la figura 1. Se apreció, en el cromatograma de la fracción HSCB, la presencia de 23 picos cromatográficos; de ellos uno mayoritario (pico 5, ácido hexadecanoico), el resto de los compuestos presente exhibió baja intensidad en sus picos cromatográficos.
Para la fracción HSCN, el cromatograma gaseoso mostró 25 componentes, de los cuales el pico cromatográfico 4 exhibió la mayor intensidad (ácido hexadecanoico), y el 7, relativa abundancia (ácido 7, 8, 11-octadecatrienoico); el resto, aunque de baja intensidad, denota una concentración superior a los observados en la fracción HSCB.
El cromatograma gaseoso analítico de la fracción de ácidos grasos de los tallos TSC, se presenta en la figura 2, mostrando 23 picos cromatográficos, de los cuales el 6 es el de mayor abundancia en la fracción (ácido hexadecanoico), considerándose el resto como minoritarios.
En el caso de las flores (FSC), el cromatograma gaseoso analítico muestra la presencia de 18 picos cromatográficos (Fig. 2), de los cuales el representado por el número 3 es el mayoritario (ácido hexadecanoico).
En la tabla 1 se expone un resumen comparativo de los compuestos encontrados en los diferentes órganos vegetales estudiados. En total se asignaron estructuras a 29 compuestos, de estos, 23 se encuentran presentes en las hojas, 18 en los tallos y 18 en las flores. El ácido graso de mayor abundancia en todos los órganos vegetales fue el hexadecanoico (ácido palmítico) y los mayores porcentajes se registraron en hojas y flores. Se encontró que 6 de los ácidos grasos se hallaban solamente en las hojas, uno en los tallos y dos en las flores.
Los compuestos insaponificables presentes en las fracciones lipídicas, fueron también analizados. En la figura 3 se muestran los cromatogramas gaseosos analíticos de las fracciones insaponificables de las hojas (HICB, HICN).
Los cromatogramas mostraron, en ambos casos, poca complejidad, detectándose la presencia de dos picos cromatográficos, que comparados sus espectros con los de la base de datos del equipo resultaron ser la ß-amirina (pico1) y el lupeol (pico 2).
La fracción de compuestos insaponificables
de los tallos (TIC) presentó un cromatograma más complejo
que el de las hojas, con la presencia de 6 picos cromatográficos (Fig.
3), de ellos, el mayoritario resultó el pico cromatográfico
4 (![]() -amirina
+ lupeol). El cromatograma gaseoso de los compuestos insaponificables de las
flores (FIC) presentó 5 componentes, destacándose también
por la presencia de un compuesto mayoritario, representado por el pico cromatográfico
2 (
-amirina
+ lupeol). El cromatograma gaseoso de los compuestos insaponificables de las
flores (FIC) presentó 5 componentes, destacándose también
por la presencia de un compuesto mayoritario, representado por el pico cromatográfico
2 (![]() -amirina)
(Fig. 3). La asignación estructural de los diferentes
compuestos se refleja en la tabla 2.
-amirina)
(Fig. 3). La asignación estructural de los diferentes
compuestos se refleja en la tabla 2.
Como se observa, la fracción insaponificable
está constituida fundamentalmente por triterpenoides, de ellos el lupeol
resultó el componente mayoritario de las hojas, la ß-amirina de
los tallos y la ![]() -amirina de las
flores; aunque debe señalarse que se encontró en tallos una mezcla
abundante de lupeol y
-amirina de las
flores; aunque debe señalarse que se encontró en tallos una mezcla
abundante de lupeol y ![]() -amirina.
-amirina.
La ß-amirina y el lupeol se encontraron
en todos los órganos vegetales, el glutinol y el acetato de taraxasterol
solo se encontraron en tallos, y el taraxasterol y el neoganmacer únicamente
en las flores. La ![]() -amirina
se encontró como componente de tallos y flores.
-amirina
se encontró como componente de tallos y flores.
Como conclusiones del trabajo se señalan la identificación de 29 ácidos grasos y 8 triterpenoides, como componentes de la fracción lipídica de las hojas, tallos y flores de la especie Vernonanthura patens. Estos resultados son informados por primera vez para la especie.
REFERENCIAS BIBLIOGRÁFICAS
1. Clawell A. Las Compuestas en Honduras. Ceiba. 1975;19(1):239.
2. Nash DL. Flora de Guatemala. Firldiana Botany. 1976;24(12):28.
3. Argueta A. Atlas de las plantas de la medicina tradicional Mexicana. t. 1. Editorial. México: Instituto Nacional Indigenista (INI); 1994. p. 512. ISBN:968-29-7323-6.
4. Aguirre N, Hofstede R, Sevink J, Ordoñez L. Sistemas forestales en la costa del Ecuador: una propuesta para la zona de amortiguamiento de la reserva Mache-Chindul. Quito-Ecuador; 2001. p. 18.
5. Blair S, Madrigal B. Plantas antimaláricas de Tumaco: Costa Pacífica Colombiana. Antioquia-Colombia: Universidad de Antioquia; 2005. p. 84-871. ISBN: 958-655-803-7.
6. Valadeau C, Pabon A, Deharo E, Albán-Castillo J, Estévez Y, Lores F, et al. Medicinal plants from the Yanesha (Peru): Evaluation of the leishmanicidal and antimalarial activity of selected extracts. J Ethnopharmacol. 2009;123(3):413-22.
7. Gacheta M, Salazar J, Kaiserc M, Brunc R, Navarrete H, Muñoz R, et al. Assessment of anti-protozoal activity of plants traditionally used in Ecuador in the treatment of leishmaniasis. J Ethnopharmacol. 2010;128(1):184-97.
8. Mabry TJ, Abdel-Baset Z, Padolina WG. Systematic implications of flavonoides and sesquiterpene lactones in species of Vernonia. Biochemical Sistematics Ecology. 1975;2(3-4):185-92.
9. Jakupovic J, Schmedia-Hirschmann G. Hirsutinolides, glaucolides and sesquiterpene lactones in species of Vernonia. Biochem Phytochemistry. 1986;25(2):145-58.
10. Lou Zhi-cen. General control methods for vegetable drugs. Comparative study of methods included in thirteen pharmacopoeias a proposal on their international unification. Ginebra: WHO/PHARM/80.502; 1980. p. 8-39.
11. Miranda M, Cuéllar A. Farmacognosia y Productos Naturales. La Habana: Editorial Félix Varela; 2001. p. 207-22.
12. Beyer H, Waltter, W. Manual de Química orgánica. Versión española de la 9na ed. alemana. Barcelona: Editorial Reverté S.A.; 1987. p. 262-4. ISBN 84-291-7066-9.
Recibido: 4 de abril de 2013.
Aprobado: 6 de abril de 2013.
Patricia Manzano Santana. Escuela Superior Politécnica del Litoral (ESPOL). Centro de Investigaciones Biotecnológicas de la ESPOL (CIBE). Km. 30.5 Vía Perimetral, Campus Proserpina, Apartado: 09-01-5863. Fax: (593-4) 2 854629. Guayaquil-Ecuador. Correos electrónicos: pmanzano@espol.edu.ec; manzanopatricia@hotmail.com