ARTÍCULO ORIGINAL
Novedoso método para la preparación de tinturas al 20 % de Antigonon leptopus (coralillo) y Sida rhombifolia L. (hierba aura)
A novel method to prepare 20% tinctures of Antigonon leptopus (coral vine) and Sida rhombifolia L. (jelly leaf)
Yolanda Margarita Rosales FernándezI, Milegnis Acosta BaldoquínI, Yosvel Viera TamayoII, Galina Morales TorresI
I Centro
de Estudio de Química Aplicada. Facultad de Ciencias Técnicas. Universidad
de Granma. Bayamo, Cuba.
II Centro
de Estudio de Biotecnología. Facultad de Agronomía. Universidad de
Granma. Bayamo, Cuba.
RESUMEN
Introducción:
La extracción es uno de los procesos farmacéuticos más utilizados
para separar los principios activos presentes en los tejidos de plantas y animales.
Debido a la composición compleja y a las bajas concentraciones de los metabolitos
en los tejidos, es fundamental seleccionar adecuadamente el método de extracción.
En la actualidad, uno de los métodos más eficientes es la extracción
asistida por ultrasonido (EAUS) que utiliza sonidos de alta frecuencia para
desprender los compuestos de interés del material vegetal. Esta es una
técnica económica y requiere pocos instrumentos.
Objetivo:
Comprobar la eficiencia de la extracción asistida por ultrasonido en comparación
con los métodos tradicionales de extracción por maceración y
percolación para preparar tinturas al 20 % de Antigonon
leptopus Hook. & Arn. (coralillo)
y Sida rhombifolia L.
(hierba aura).
Métodos:
Se prepararon tinturas al 20 % mediante tres métodos (maceración,
percolación y ultrasonido) a partir de la droga pulverizada. Como disolvente
se utilizó una solución hidroetanólica al 70 %. Se realizó
el tamizaje fitoquímico y se determinaron los índices de calidad.
Resultados:
Para comparar los métodos de extracción se tuvo en cuenta el tiempo
y para evaluar la eficacia de estos métodos se comparó el rendimiento.
Se demostró que el más eficiente de los métodos de extracción
fue la extracción asistida por ultrasonido. Se comprobó la existencia
de una gran diversidad de metabolitos secundarios en las tinturas elaboradas
en las cuales predominaron los alcaloides. Los parámetros de la calida
demuestran que las tinturas al 20 % no sufrieron cambios relevantes que afectaran
su calidad, por tanto, poseen una determinada estabilidad y son inocuas.
Conclusiones:
La obtención de tinturas al 20 % de Antigonon
leptopus mediante extracción asistida por ultrasonido
tuvo rendimientos superiores con un considerable ahorro de tiempo, cumplió
con las especificaciones necesarias de la calidad en las condiciones establecidas
y se identificaron en mayor proporción los alcaloides.
Palabras claves: Antigonon leptopus subsp. Cocineum Hook & Arn; Sida rhombifolia L.; ultrasonido; tintura; tamizaje fitoquímico; calidad.
ABSTRACT
Introduction:
Extraction is one of the most common pharmaceutical processes. It is used to
separate the active principles present in plant and animal tissues. Due to the
complex composition and the low concentrations of metabolites in tissues, it
is essential to adequately select the extraction method to be applied. One of
the most efficient extraction methods in current use is ultrasound-assisted
extraction (UAE), which uses high frequency sounds to withdraw the compounds
of interest from the plant material. UAE is an economical technique requiring
little instrumentation.
Objective:
Verify the efficiency of ultrasound-assisted extraction as compared with the
traditional extraction methods of maceration and percolation to obtain 20% tinctures
of Antigonon leptopus Hook. & Arn. (coral vine) y Sida rhombifolia
L. (jelly leaf).
Methods:
The 20% tinctures were obtained from the pulverized drug by three extraction
methods: maceration, percolation and ultrasound. A 70% hydroethanolic solution
was used as solvent. Phytochemical screening was performed and quality indices
were determined.
Results:
Time was taken into account on comparing the extraction methods, and yields
were compared to evaluate efficacy. It was found that the most efficient of
the three methods was ultrasound-assisted extraction. Existence was verified
of a wide variety of secondary metabolites in the tinctures, with a predominance
of alkaloids. Quality parameters show that the 20% tinctures did not undergo
any relevant changes affecting their quality, i.e. they have a certain level
of stability and are safe.
Conclusions:
Extraction of 20% tinctures from Antigonon leptopus by UAE had higher
yields with considerable time saving, and met the required quality specifications
under the conditions established. There was a higher proportion of alkaloids.
Key words: Antigonon leptopus subsp. Cocineum Hook & Arn, Sida rhombifolia L., ultrasound, tincture, phytochemical screening, quality.
INTRODUCCIÓN
En la actualidad, las investigaciones dirigidas a producir medicamentos más seguros y efectivos para el tratamiento de enfermedades, encuentran en la medicina natural una importante fuente para las indagaciones en este campo, lo que da lugar a una tendencia a preferir los productos farmacéuticos naturales. El estudio de las plantas medicinales encaminado a los resultados de las pruebas biológicas tiene como objetivo identificar, aislar y caracterizar los principios activos responsables de la bioactividad, para esto es crucial la correcta selección del método de extracción.1,2
En algunos casos se ha determinado que la extracción puede ser más económica que la síntesis química de los compuestos, motivo por el cual una extracción que permita mayor productividad y sea amigable con el medio ambiente es de gran interés para la ciencia.
El novedoso método de extracción asistida por ultrasonido (EAUS) con respecto a los métodos tradicionales de extracción de los principios activos se ha aplicado con resultados prometedores en la industria farmacéutica, porque tiene como ventajas la sencillez de los equipos, el ahorro inicial de los costos y la reducción del tiempo para realizar las extracciones.3-8
La más común de las formulaciones farmacéuticas es la tintura9-12 y debido a la alta biodisponibilidad de las plantas es posible preparar tinturas para su uso terapéutico.
Por la importancia y actualidad del tema se establecieron los aspectos técnicos necesarios para desarrollar una investigación sobre Antigonon leptopus subsp. Cocineum Hook & Arn (coralillo) y Sida rhombifolia L. (hierba de aura).
A. leptopus es una planta trepadora con zarcillos presentes en las terminaciones de las inflorescencias, tiene raíces tuberosas, alcanza hasta 10 m de largo. El tallo con entrenudos mide de 1 a 10 cm de largo y de 1 a 4 mm de grosor. Las hojas son alternas, espiraladas, simples, con pecíolo de 4 a 30 mm de largo por 0,5 a 1,5 mm de grosor. Pertenece al reino Plantae, familia Polygonaceae y género Antigonon. Se le conoce también como: cadena de amor, rosa de mayo, bellísima, corona de la reina. Es nativa de México y Centroamérica, crece en toda Cuba en terrenos yermos. Esta especie se utiliza contra la tos, la fiebre o la inflamación de la garganta. Contra las enfermedades venéreas, el tallo se machaca y se elabora un emplasto para aplicarlo localmente. Se reporta su uso contra infecciones fúngicas y bacterianas.13
S. rhombifolia es una hierba anual o arbusto de 50 cm a 1,50 m de altura con tallos muy ramificados. Las hojas son a veces más anchas en el centro o un poco alargadas y con bordes dentados. Las flores son amarillas, parecen pequeñas campanitas escondidas entre las ramas. Sus frutos se ven como farolitos con una punta y son verdes. Pertenece al reino Plantae, familia Malvaceae y género Sida. Se le conoce también como: malva, malva amarilla, malva de cochino, escobilla, malvavisco, malva de escoba, y es originaria de las regiones tropicales y subtropicales del mundo. Se emplea para combatir granos, tumores cutáneos, sarampión, úlceras en la piel y úlceras externas en los órganos genitales. Para tratar la caída del cabello el cocimiento de las ramas o de las hojas molidas en agua se usa como enjuagues. Se usa en general en enfermedades del estómago, cuando hay dolor, gastritis o úlceras estomacales, en trastornos del tracto intestinal y como antidiarreico contra la disentería. En otros tipos de lesiones se utiliza en lavados como desinfectante.14-16
En nuestro país, aunque el avance científico en este tipo de investigación es notable, todavía existe un gran número de plantas sin estudiar. Esta investigación pretende comprobar la eficiencia la eficiencia de la extracción asistida por ultrasonido en comparación con los métodos tradicionales para preparar tinturas al 20 % de Antigonon leptopus y Sida rhombifolia.
MÉTODOS
Se seleccionaron las plantas A. leptopus y S. rhombifolia teniendo en cuenta lo que conoce la población sobre su empleo para el tratamiento de diversas afecciones de la piel. Aunque esos efectos terapéuticos no han sido validados experimentalmente, se consideró la disponibilidad de la planta. Las plantas se recolectaron en diciembre de 2012 en la finca de autoabastecimiento de la escuela especial "Celia Sánchez Manduley" de Veguitas, municipio de Yara, provincia Granma. Se empelaron las hojas y las flores de A. leptopus y el follaje de S. rhombifolia. Las plantas se herborizaron e identificaron en el Jardín botánico "Copaynicú" de Guisa, Granma, con los números de serie A. leptopus (3011) y S. rhombifolia L. (3012).
El material vegetal se lavó y desinfectó con una solución de hipoclorito de sodio al 2 %, se extendió en bandejas y se secó a la sombra a temperatura ambiente. Se voltéo todos los días durante una semana y después se secó a temperatura de 60 °C durante 1 h en estufa (WSU 400, Alemania) con circulación de aire. A continuación se pulverizó la droga que se empleó para elaborar las tinturas al 20 % y se empleó como disolvente etanol al 70 %.
Se utilizaron tres métodos de extracción. Después de la extracción y alcanzada la homogeneidad y transparencia total de las tinturas, se envasaron en frascos ámbar para evitar la descomposición de los compuestos activos por la acción de la luz, ya que diversas sustancias activas extraídas de las plantas son fotosensibles.
Las muestras se dejaron reposar por tres días en refrigeración a 8 °C y luego se sometieron a los análisis de calidad y al tamizaje fitoquímico. Los ensayos se repitieron a los seis meses en muestras testigos de cada tintura para realizar las respectivas comparaciones.
Las tinturas al 20 % se sometieron al proceso de eliminación del disolvente a través de rotoevaporación a baja presión (rotoevaporador KIKA, Alemania).
Elaboración
de las tinturas al 20 %
Métodos de extracción
Maceración
Se pesaron 5 g de la droga cruda en una balanza técnica (Sartorius, BS2202S, China). Para obtener 25 mL de tintura al 20 % se agitó continuamente por espacio de siete días en la zaranda (ILM tipoTHZS2, Alemania).17
Percolación
Se pesaron 5 g de la droga cruda en una balanza técnica (Sartorius, BS2202S, China). Para obtener 25 mL de tintura al 20 % se utilizó un equipo lixiviador o percolador que retiene la droga. Se humedeció en capas y se añadió el disolvente utilizando una cantidad hasta tapar la droga y sobrepasarla en 0,5 cm de altura y se dejó durante 24 h.17
Ultrasonido
Las extracciones asistidas por ultrasonido se llevaron a cabo de acuerdo con el procedimiento descrito por Benelli y otros.18 Se pesaron 5 g de la muestra previamente humedecida para obtener 25 mL de tintura al 20 %. Conectado en un condensador, el sistema se mantuvo con ondas ultrasónicas durante 2 h a temperatura ambiente. El equipo utilizado fue un baño de ultrasonido (SB-3200DT, China) que trabaja con frecuencia de 40 kHz y potencia de 180 V.
Tamizaje fitoquímico
El tamizaje fitoquímico se realizó en el Laboratorio de Productos Naturales del Centro de Estudio de Química Aplicada (CEQA) de la Universidad de Granma mediante la metodología reportada por Payo, Sandoval y Peña.19-21 Se emplearon pruebas o técnicas simples, rápidas y selectivas para cada compuesto. A cada extracto se les realizaron las pruebas específicas para los metabolitos secundarios que de acuerdo con su solubilidad podían haber sido extraídos en cada solvente.
Control de la calidad
La determinación de las especificaciones del control de la calidad de las tinturas al 20 % se realizó para cuatro parámetros: pH, índice de refracción, sólidos totales y densidad relativa según la NRSP 31222 y la NC 92-02.23
Para determinar el pH se realizaron tres mediciones a 25 °C y humedad de 38 % con un pehachímetro (Hanna 211, Portugal). Se calculó el promedio de las lecturas efectuadas y el valor obtenido se reportó como el pH de la tintura.
El índice de refracción se determinó según WHO Pharm 92.559 24 y la NC 90-13-1125 empleando un refractómetro (Abbe YA-2S, China) y se trabajó sin corrección a 25 °C. Se realizaron tres lecturas y se calculó el promedio. El valor se aproximó, y se informó como el índice de refracción (nD25).
El ensayo para determinar los sólidos totales se realizó tres veces según la NRSP 312.22 Se promediaron los valores obtenidos; se aproximó el resultado y se reportó como la cantidad de sólidos totales (St) en 100 mL de tintura al 20 %.
Se determinó la densidad relativa mediante picnometría según WHO Pharm 92.559 24 con un picnómetro estándar ASTM D-854. El ensayo se realizó tres veces con una diferencia inferior a 0,005 entre las determinaciones. Se aproximó el promedio de los resultados y se informó como el valor de la densidad relativa (ρr25) de la tintura al 20 %.
Eficiencia del método
La eficiencia se calculó como la razón del rendimiento (extracto seco de la tintura/droga vegetal utilizada para preparar la tintura) y el tiempo necesario para alcanzar esa extracción.
RESULTADOS
Para preparar la tintura al 20 % se utilizaron tres métodos: maceración, percolación y ultrasonido. Como la composición química depende de las funciones específicas de las plantas, para corroborar la acción antibacteriana de Antigonon leptopus y Sida rhombifolia se determinó su composición (tabla 1) mediante tamizaje fitoquímico.
Determinación
de las especificaciones del control de la calidad
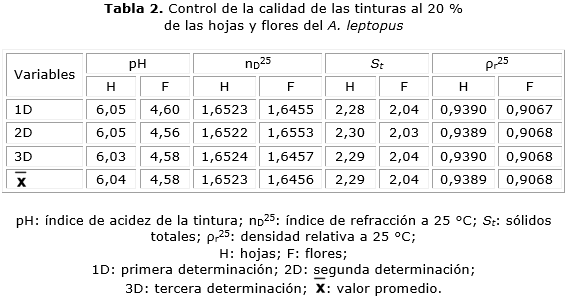
Los resultados que se muestran en las tablas 2 y 3 se encuentran dentro de los valores de la calidad establecidos en las normas utilizadas, lo que permite garantizar una determinada seguridad para la utilización óptima de estas tinturas con fines terapéuticos.
Transcurridos 6
meses se repitieron los ensayos en las muestras testigos.
DISCUSIÓN
En el tamizaje fitoquímico realizado a las tinturas al 20 % (tabla 1) se observa gran variedad de metabolitos secundarios en las hojas y flores de A. leptopus y en el follaje de S. rhombifolia, en las tinturas de ambas plantas se destacan los alcaloides. La gran diversidad de metabolitos secundarios presentes justifica la utilidad atribuida a estas plantas. Un resultado importante es el hecho de que para las dos plantas objeto de estudio independientemente del método utilizado la composición de metabolitos es muy semejante.
En las hojas y flores de A. leptopus y en el follaje de S. rhombifolia se observa un ligero aumento del rendimiento cuando se empleó la extracción asistida por ultrasonido en comparación con la maceración y percolación (tabla 1). Motivo por el cual el criterio de mayor peso para determinar la eficiencia del método fue el tiempo que se necesitó para realizar el proceso, con ventajas para la EAUS, pues solamente se necesitan 2 h para obtener una tintura con mayores rendimientos y CON la misma composición fitoquímica que mediante los métodos tradicionales de maceración y percolación; además de su bajo costo y la posibilidad de extracción a bajas temperaturas. Estos resultados corresponden a los de Azuola y Vargas19 quienes demostraron que la EAUS es más eficiente que los métodos de extracción tradicionales, y más económica y sencilla que los métodos de extracción no tradicionales, por ejemplo, la extracción asistida por microondas. Diferentes autores llegaron a resultados similares en la última década y todos coincidieron en que la EAUS es un método eficaz y factible para el trabajo en el laboratorio y en la industria para trabajar con productos naturales.5,27-29
Otros estudios que corroboran la eficacia del método de extracción con ultrasonido son los referentes a la determinación de los índices de calidad de los extractos vegetales. Al analizar los resultados de la determinación de los parámetros de calidad en la tintura al 20 % de las hojas del A. leptopus (tabla 2), las determinaciones del pH indican que existe cierto equilibrio entre las cantidades de compuestos ácidos y básicos o que la mayoría de ellos tienen pH neutro, lo que provoca una reducción de la catálisis ácida o básica que, habitualmente, es la principal causa de la degradación hidrolítica de los principios activos en las formulaciones farmacéuticas.30 El índice de refracción supera al que se determinó para el agua destilada y coincide con lo reportado.31 El promedio de sólidos totales por cada 100 mL de tintura al 20 % de las hojas, indica que en los estudios de cuantificación se alcanzan cifras elevadas de concentración para los compuestos disueltos más abundantes, lo que se corobora con el valor medio de la densidad relativa a 25 °C.32
Los parámetros de la calidad de la tintura al 20 % de las flores (tabla 3) mostraron valores promedio de los índices de refracción muy parecidos a los de las hojas; sin embargo, el valor promedio de pH ligeramente ácido muestra una mayor concentración de compuestos ácidos; por su aprte, la densidad relativa y los sólidos totales por cada 100 mL de tintura al 20 % dejaron ver algunas divergencias, principalmente en este último indicador, en el que se advierte una diferencia a favor de la tintura al 20 % de las hojas, lo que demuestra una mayor concentración de los principios activos. Se supone que la cantidad de sólidos totales encontrados en este producto ha repercutido directamente en el incremento de su densidad relativa.
Los parámetros del control de la calidad medidos para la tintura del follaje de la S. rhombifolia (tabla 3) se comportaron de forma similar a los resultados de las tinturas de las hojas y flores de A. leptopus (tabla 2), los cuales están dentro de los parámetros de la calidad que establecen las normas para el uso de las formulaciones.
La comparación de los valores que se muestran en las tablas 4 y 5 con respecto a los de las tablas 2 y 3 indica que, en las condiciones descritas, los parámetros de la calidad han permanecido sin alteraciones significativas durante 6 meses; por lo tanto, es lógico pensar que la composición y calidad de las tinturas al 20 % de las hojas y las flores del A. leptopus y del follaje de S. rhombifolia no han experimentado cambios relevantes en este tiempo que puedan comprometer su calidad farmacéutica y, desde esta perspectiva, posee una determinada estabilidad. Este hecho constituye una garantía de la calidad y seguridad del producto con vistas a someterlo a investigaciones dirigidas a la comprobación experimental de sus propiedades biológicas.
Se ha demostrado que la extracción asistida por ultrasonido es más
eficiente que la extracción por métodos tradicionales. Además,
las tinturas al 20 % obtenidas de los órganos de A. leptopus y S.
rhombifolia tienen diferente composición desde el punto de vista fitoquímico
y cumplen los requisitos de calidad farmacéutica establecidos, por lo que
se recomienda el uso del método de extracción asistida por ultrasonido
para las futuras investigaciones con estas plantas.
Conflicto de intereses
Los autores no tienen conflicto de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Conferencia de las Naciones Unidas sobre Comercio y Desarrollo. Systems and Nacional Experiences for Protecting Traditional Knowledge, Innovations and Practices. Background Note by the UNCTAD Secretariat. Ginebra; 2008.
2. Peña AR, Torres E. Monografías de Productos Naturales. Universidad de Granma; 2006.
3. Vinatoru M. An overview of the ultrasonically assisted extraction of bioactive principles from herbs. Ultrason. Sonochem. 2001;8(3):303-13.
4. Luque-García JL, Luque de Castro MD. Ultrasound: a powerful tool for leaching. Trends Anal. Chem. 2003;22(1):41-47.
5. Salisova M, Toma S, Mason TJ. Comparison of conventional and ultrasonically assisted extractions of pharmaceutically active compounds from Salvia officinalis. Ultrason. Sonochem. 1997;4(2):131-4.
6. Vinatoru M, Toma M, Radu O, Filip PI, Lazurca D, Mason TJ. The use of ultrasound for the extraction of bioactive principles from plant materials. Ultrason. Sonochem. 1997;4(2):135-9.
7. Otterbach A, Wenclawiak BW. Ultrasonic/Soxhlet/supercritical fluid extraction kinetics of pyrethrins from flowers and allethrin from paper strips. Fresenius J. Anal. Chem. 1999;365(5):472-4.
8. Valachovich P, Pechova A, Mason TJ. Towards the industrial production of medicinal tincture by ultrasound assisted extraction. Ultrason. Sonochem. 2001;8(2):111-7.
9. MINSAP. Plantas Medicinales. FITOMED II. La Habana. Ed. Ciencias Médicas; 1993.
10. Árboles, Plantas Medicinales, Remedios Naturales. Propiedades [citado 17 de octubre de 2012]. Disponible en: http://www.wanamey.Org/plantas/plantas-medicinales-aplicación.htm.
11. British Pharmacopoeia CD-ROM. British Pharmacopoeia. Volume III. Monographs. Formulated Preparations: General Monographs; 2009.
12. Legislación en Iberoamérica sobre fitofármacos y productos naturales. Resúmenes. II Congreso de Fitoterapia-XXIII. Reunión de la AEMN-II Reunión de SEFIT [citado 12/2/2013]. Disponible en: http://www.medicina-naturista.net
13. Antigonon_leptopus [citado 20 de enero de 2013]. Disponible en: http://es.wikipedia.org/w/index.php?title=Antigonon_leptopus&oldid=63342386
14. Pio FQ. Plantas medicinales. Ed. Labor, España, 1990;829-35.
15. Malva bruja. Planta con propiedades curativas que se emplea para eliminar los gases intestinales, también para tratar la diarrea infantil [citado 17 de diciembre de 2012]. Disponible en: http://www.ecured.cu/index.php/Malva_bruja
16. Escobilla o malvilla, Biblioteca Digital de la Medicina Tradicional Mexicana. 2009 © D.R. [citado 2 de febrero de 2013]. Disponible en: www.velvet.unam.mx
17. Cuba. Ministerio de Salud Pública. NRSP No. 311. Medicamentos de origen vegetal: extractos fluidos y tinturas. Procesos tecnológicos. La Habana. Editorial Ciencias Médicas; 1998.
18. Benelli P, Riehl C, Smania Jr A, Smania EFA, Ferreira SRS. Bioactive extracts of orange (Citrus sinensis L. Osbeck) pomace obtained by SFE and low pressure techniques: Mathematical modeling and extract composition. Journal of Supercritical Fluids. 2010;55(1):132-41.
19. Payo A, Oquendo M, Oviedo R. Tamizaje fitoquímico preliminar de plantas que crecen en Sierra de Nipe, Holguín. Rev Cubana de Farmacia. 2001;30(2):54-60.
20. Payo A. Tamizaje Fitoquímico del Croteun L. Rev Cubana Farm. 2001;35(3):120-31.
21. Sandoval D y Suárez O. Estudio Fitoquímico preliminar de detección de alcaloides y saponinas en plantas que crecen en Cuba. Rev Cubana Farm. 1990;24(2):288-96.
22. Cuba. Ministerio de Salud Pública. NRSP No. 312. Medicamentos de origen vegetal: extractos fluidos y tinturas. Métodos de ensayos. La Habana. Editorial Ciencias Médicas; 1998.
23. NC 92-02. Control de la calidad. Muestreo de líquidos. Ed. 2009. La Habana, Cuba.
24. WHO Pharm 92.559. Quality control methods for medicinal plant materials. 1992;(5).
25. NC 90-13-11. Aseguramiento metrológico. Refractómetros. Reglas generales para efectuar determinaciones refractométricas. Ed. 2009. La Habana, Cuba.
26. Azuola R, Vargas P. Extracción de sustancias asistida por ultrasonido (EUA). Rev. Tec. en Marcha. 2007;20(4):30-40.
27. Gao M, Liu C. Comparison of techniques for the extraction of flavonoids from cultured cells of Saussurea medusa Maxim. World Journal of Microbiology & Biotechnology. 2005;21(8-9):1461-63.
28. Kimbaris AC, Siatis NG, Daferera DJ, Tarantilis PA, Pappas CS, Polissiou MG. Comparison of distillation and ultrasound assisted extraction methods for the isolation of sensitive aroma compounds from garlic (Allium sativum). Ultrasonics Sonochemistry. 2006;13(1):54-60.
29. Djilani A, Legseir B, Soulimani R, Docko A, Younous C. New extraction technique for alkaloids. Journal of Brazilian Chemical Society. 2006;17(3):518-20.
30. Vila Jato JL et al. Tecnología Farmacéutica. Aspectos fundamentales de los sistemas farmacéuticos y operaciones básicas. Ed. Síntesis. 2008;339-41.
31. Índice de refracción. Valores para diferentes materiales [citado 23 de marzo de 2013]. Disponible en: http://www.w3c.org/TR/1999/REC-html401-19991224/loose.dtd
32. Cseke LJ et al. Natural Products from Plants. Second Edition. NY: CRC Press Taylor & Francis Group. 2006;377-9.
Recibido: 28 de
noviembre de 2013.
Aprobado: 8 de febrero
de 2015.
Lic. Yolanda
Margarita Rosales Fernández. Centro de Estudio de Química Aplicada.
Facultad de Ciencias Técnicas. Universidad de Granma. Bayamo, Cuba.
Correo electrónico:
gmoralest@udg.co.cu