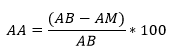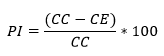ARTÍCULO ORIGINAL
Actividad antioxidante y antifúngica de piperaceaes de la flora colombiana
Antioxidant and antifungal activity from colombian piperaceas
MSc. Yaned Milena Correa Navarro,I MSc. Lady Rossana Palomino García,II MSc. Oscar Marino MosqueraII
I
Grupo de Biotecnología-Productos Naturales. Universidad de Caldas. Manizales,
Colombia.
II
Grupo de Biotecnología-Productos Naturales. Universidad Tecnológica
de Pereira. Colombia.
RESUMEN
Introducción:
la dificultad existente en el tratamiento de las enfermedades fúngicas,
debido a la resistencia generada por los hongos patógenos a los medicamentos
hoy en uso, y las múltiples enfermedades generadas por las especies reactivas
de oxígeno (cáncer, diabetes, problemas cardiovasculares, entre
otras), ha suscitado el interés creciente en la búsqueda de nuevos
productos antifúngicos y antioxidantes, para el tratamiento de las dolencias
con estos orígenes. La familia Piperaceae es muy conocida por
sus actividades biológicas variadas, lo cual permite encontrar en especies
de esta familia, fitocompuestos con buen potencial biológico para tratar
estas afecciones.
Objetivo:
evaluar la actividad antioxidante y antimicótica de los extractos de
diferente polaridad, de 8 especies de Piperaceaes colectadas en el
Parque Regional Natural Ucumarí, en Colombia.
Métodos:
el material vegetal (tallos y hojas) se secó, se molió y después
se extrajo por percolación con n-hexanos, dicloromentano y metanol.
Las soluciones obtenidas se concentraron a presión reducida y con los
extractos crudos se evaluaron las actividades antioxidantes mediante el procedimiento
del difenilpicrilhidrazilo y la antifúngica, a través de la metodología
de placa perforada; de conjunto se realizó un tamizaje fitoquímico
por cromatografía de placa delgada.
Resultados:
los extractos metanólicos fueron más bioactivos en los dos ensayos
realizados, son las especies Piper eriopodon y Piper crassinervium,
las que presentaron la mejor actividad antioxidante; mientras que en la evaluación
de la actividad antifúngica Piper pesaresanum y Piper eriopodon
mostraron mayor porcentaje de inhibición. El tamizaje fitoquímico
evidenció que los metabolitos secundarios con mayor presencia en estas
especies fueron: alcaloides, fenoles, taninos, terpenos, triterpenos, esteroides,
saponinas, flavonoides y antraquinonas.
Conclusiones:
sugieren que Piper eripodon presenta propiedades tanto antioxidante
como antifúngica; por lo cual, tiene un alto potencial como fuente de
compuestos bioactivos que podrían ser usados como alternativas terapéuticas
o industriales.
Palabras clave: antimicrobiano, bioprospección, capacidad atrapadora de radicales libres, productos naturales, tamizaje fitoquímico.
ABSTRACT
Introduction:
treatment for human fungal diseases has many problems associated to resistance
of pathogenic fungi to currently used drugs, in addition, many sicknesses
caused by reactive oxygen species (ROS) such cancer, inflammation, diabetes,
cardiovascular disease, among others, have generated increasing interest in
the search for new antifungal as well as antioxidant product with novel mechanism
of action for treatment of affections related to these origins. Piperaceae
family is widely known for its different biological activities; for that reason
it could be possible to find interesting phytocompounds with many pharmaceutical
potencial.
Objetive:
to evaluate the antioxidant and antifungal activities of n-hexanes,
dichloromethane and methanol extract from 8 species belonging to the Piperaceae
family collected in Regional Natural Park Ucumarí (Colombia).
Methods:
the plant material (leaves and branches) was dried and ground, after that,
was extracted by percolation with n-hexanes, dichloromethane and methanol.
The plant extracts obtained were concentrated under reduced pressure and used
to determine the antioxidant activity by difenilpicrilhidrazilo methodology
while for the antifungal activity the perforated plate procedure was developed.
Also was performed a phytochemical screening by thin layer chromatography.
Results:
in both biological activities evaluated the methanol extracts were most active
than the others extracts. Piper eripodon and Piper crassinervium
were the species with the best antioxidant activity, and Piper pesaresanum
followed by Piper eriopodon were the species with best antifungal
activity. Phytochemical analysis showed that alkaloids, phenols, tannins,
terpenes, triterpenes, steroids, saponins, flavonoids and antraquinones were
the most abundant compounds presents in the extracts of the eight species
evaluated.
Conclusions:
results show that Piper eripodon has antioxidant and antifungic
properties; this specie has great potential as a source of bioactive compounds
that could be used as new pharmaceutical or industrial alternatives.
Key words: antimicrobial, bioprospection, free radical scavenging, natural products, phytochemical screening.
INTRODUCCIÓN
Las plantas son consideradas como una fábrica de productos químicos gracias a la gran variedad de metabolitos secundarios que biosintetizan, muchos de ellos tienen importancia comercial y son utilizados en industrias tales como: farmaceútica, agrícola, alimentaria, cosmética, colorante, entre otras.1 Estos metabolitos secundarios cumplen diferentes funciones ecológicas en el desarrollo de las plantas, entre las cuales se pueden mencionar: la de regulación del crecimiento, las interacciones intra e inter específicas y de defensa contra agentes causantes de enfermedades y depredadores.2
En los últimos años se han incrementado las investigaciones relacionadas con productos naturales bioactivos.3 El interés específico por conseguir nuevos agentes antioxidantes reside en la necesidad de combatir los radicales libres, los cuales están íntimamente asociados con la génesis de múltiples enfermedades tales como: el cáncer, la inflamación, el envejecimiento prematuro, los problemas cardiovasculares, la diabetes, los desórdenes neurodegenerativos, entre otras.4 Por otra parte, la búsqueda de nuevos agentes antifúngicos radica en la alta complejidad implícita en el tratamiento de las infecciones fúngicas, debido a la resistencia que éstos patógenos han desarrollado a los agentes comercial disponibles, por lo cual se presenta mayor morbilidad y mortalidad.5
La familia Piperaceae es una de las más grandes, importantes y antiguas en la historia de la humanidad, desde tiempos remotos se tienen registros del uso de especies de esta familia para diferentes dolencias.6,7 Las variedades pueden ser hierbas, arbustos o enredaderas, rara vez son árboles; crecen en climas tropicales, subtropicales templados y habitan en lo básico, en las selvas húmedas de ambos hemisferios. Los principales géneros de esta familia son Piper y Peperomia.8 Diferentes estudios han evidenciado la actividad biológica de especies de esta familia; entre las propiedades más destacadas se encuentran: antioxidante, antidepresivo, antimutagénica, antiplaquetaria, antibacterial, antitumoral, antidiarréico, antiasmático, antiinflamatorio, antitiroidal, antihipertensiva, hepatoprotectiva, antifúngico, antimalárico, citotóxica, analgésica, entre otras.9-14
Con el fin de ampliar el conocimiento de las propiedades bioactivas de la flora en zonas de reserva de la región cafetera colombiana, se evaluaron las actividades antioxidante y antifúngica de 8 especies de plantas pertenecientes a la familia Piperaceae y en conjunto se realizó un tamizaje fitoquímico por cromatografía de placa delgada (CCD).
MÉTODOS
Material vegetal y obtención de los extractos
Este estudio se realizó con 8 especies de plantas de la familia Piperaceae,
recolectadas en el Parque Regional Natural Ucumarí (PRNU), las cuales
fueron clasificadas por el Dr. Francisco Javier Roldán. Un voucher
de cada una fue depositado en el Herbario de la Universidad de Antioquia (tabla
1).
Cada una de las plantas colectadas (hojas y tallo) se secaron en un horno con aire forzado a 50 ºC durante 72 h. El material seco se molió y se tomaron alícuotas de 300 g para ser extraídas por percolación durante 48 horas sucesivo con n-hexanos; diclorometano y metanol. El proceso de extracción con cada solvente se realizó por triplicado. Todos los extractos se concentraron a 45 ºC y se almacenaron a -10 ºC hasta su utilización en ambos ensayos.15
Capacidad antioxidante por captación de radicales libres por el método
del difenilpicrilhidrazilo (DPPH)
Esta actividad se determinó por el método espectrofotométrico del radical libre difenilpicrilhidrazilo (DPPH·), se siguió la metodología de Brand-Williams y colaboradores.16 Se tomaron 0,25 mL de la solución de los extractos (1000 mg/L) y se hicieron reaccionar con 2,0 mL de solución del DPPH· a una concentración de 20 mg/L, después de un período de incubación de 30 minutos en la oscuridad, se midió la absorbancia (A) a una longitud de onda (λ) = 517 nm. Los resultados fueron calculados como porcentaje de actividad antioxidante, se empleó la siguiente fórmula:
Donde, AA = Porcentaje de actividad antioxidante; AB = Absorbancia del blanco; AM = Absorbancia de la muestra.
Los datos obtenidos fueron a continuación, traducidos en equivalentes de Trolox (μmol/g extracto) a partir de una curva de calibración (1, 2, 4, 6, 12 y 32 μM) de este compuesto. Como control positivo se utilizó hidroquinona (1000 mg/L).
Actividad antifúngica
Estas evaluaciones se realizaron con los hongos Fusarium solani (ATCC 11712) y Fusarium oxysporum (ATCC 48112), se siguió la metodología de placa perforada descrita por Daoubi y colaboradores.17 Para esto, se hicieron extendidos de ambos hongos a evaluar en agar Saboreaud Dextrosa y se incubaron durante 48 horas. Después, se retiraron con un sacabocado de 6 mm de diámetro, cilindros que contenían el inóculo del hongo en crecimiento. El inóculo se depositó en perforaciones cilíndricas de diámetro idéntico, que habían sido realizadas previo, en cajas de Petri que contenían el mismo medio de cultivo fresco pero mezclado con los diferentes extractos a evaluar a 3400 mg/L. La actividad antifúngica se determinó al medir el diámetro de crecimiento micelial cada 24 horas por 6 días, mediante el empleo de la siguiente fórmula:
Donde, PI = Porcentaje de inhibición; CC = Diámetro promedio del crecimiento del micelio en el medio del control; CE = Diámetro promedio de crecimiento del micelio en el medio del ensayo. Como control positivo se uso ketokonazole a 250 mg/L.
Caracterización fitoquímica
Los diferentes extractos crudos fueron evaluados mediante una marcha fitoquímica a través de cromatografía de capa delgada (CCD), de acuerdo a la metodología descrita por Wagner y Bladt.18 Para la elución de los componentes presentes en los extractos de n-hexanos y diclorometano se empleó el sistema n-hexanos-acetato de etilo (70:30) y para los de metanol se utilizó el de acetato de etilo-metanol-agua (100:13,5:10). Los alcaloides, esteroles, terpenos, saponinas, fenoles y flavonoides fueron detectados mediante las respectivas reacciones de caracterización: Dragendorff, anisaldehído-ácido sulfúrico, vainillina 1 % en ácido sulfúrico-etanol, cloruro férrico al 1 % y tricloruro de aluminio al 2 %. Todas las determinaciones se realizaron por triplicado y en todos los casos se emplearon patrones de comparación a concentraciones conocidas de los núcleos fitoquímicos analizados.
Análisis estadístico
Los datos obtenidos para tres ensayos independientes, cada uno con tres repeticiones, se expresan como la media ± la desviación estándar (DS) y fueron comparados por análisis de variancia (ANOVA). Diferencias de p ≤ 0,05 fueron consideradas significativas.
RESULTADOS
La capacidad antioxidante de los extractos puede ser atribuida al poder reductor, a la capacidad atrapadora de radicales libres, o a la habilidad para capturar oxígeno molecular singlete.4 En la tabla 1 se presenta la capacidad antioxidante de los extractos evaluados, expresada en equivalentes Trolox y el porcentaje de inhibición de los mismos extractos, frente a los dos hongos fitopatógenos evaluados. Se observa, que las plantas con mejor actividad antioxidante fueron P. eriopodon y P. crassinervium las cuales mostraron buena actividad con todos sus extractos y aunque estos presentaron menor capacidad atrapadora de radicales libre que el control positivo (hidroquinona: 26,81 ± 1,43), los valores son significativos. Así mismo, la especie P. umbellatum presentó actividad antioxidante apropiada con dos de sus tres extractos evaluados; mientras que P. pesaresanum y P. acuminata evidenciaron actividad antioxidante destacada sólo con uno de sus extractos.
La especie con mejor actividad antifúngica fue P. pesaresanum, la cual presentó buena inhibición con todos sus extractos frente a los dos hongos evaluados; es el extracto de diclorometano el que mostró mayor porcentaje de inhibición contra F. solani. Con menor actividad antifúngica se encontró P. eriopodon la cual fue activa con los extractos de diclorometano y de metanol frente a ambos hongos, pero los valores obtenidos fueron inferiores a los de P. pesaresanum. Es importante resaltar que con los extractos metanólicos de las dos especies mencionadas y el de P. daniel-gonzalezii no se determinó el porcentaje de inhibición frente a F. solani porque aunque hubo crecimiento, se observaron diferencias morfológicas frente al control negativo; por lo cual, también se les consideraron especies activas. Las especies P. umbellatum, P. crassinervium, P. glanduligerum y P. acuminata, evidenciaron actividad sólo con uno de sus extractos; esta última especie mostró la mayor actividad frente a F. oxysporum. En todos los casos los extractos mostraron menor porcentaje de inhibición que el control positivo (Ketokonazol 100 %).
En la tabla 2 se muestran los resultados del tamizado fitoquímico preliminar de los tres extractos evaluados (n-hexanos, diclorometano y metanol), se deduce que los extractos metanólicos mostraron alto contenido de fenoles, taninos, flavonoides, cumarinas y antraquinonas; mientras que en los extractos de diclorometano se encontraron antraquinonas, terpenos, triterpenos, esteroides y cantidades moderadas de fenoles y taninos. Por otro lado, en los extractos de n-hexanos se detectaron terpenos, triterpenos, sapogeninas esteroidales y esteroides. Esto concuerda con lo encontrado por Parmar y colaboradores,7 quienes en un estudio del género Piper reportaron doce tipos de núcleos fitoquímicos en este género: alcaloides/amidas, profenilfenoles, lignanos, neolignanos, terpenos, esteroides, kawapironas, piperólidos, chalconas y dihidrochalconas, flavonas, flavanonas.
Tabla 2. Tamizaje fitoquímico de las 8 especies pertenecientes a la familia Piperaceae colectadas en el Parque Regional Natural Ucumarí (PRNU)
|
Nombre científico/ número |
Tipo de extracto |
Núcleo fitoquímico |
|||||||
|
Alca-loides |
Fenoles y taninos |
Terpenos, triterpenos y esteroides |
Saponinas |
Flavo-noides |
Lactonas y sesquiter-penlacto-nas |
Cuma-rinas |
Antraquinonas |
||
|
Piper eriopodon C. DC./4007 |
n-Hexanos |
- |
- |
- |
++ |
+ |
- |
- |
- |
|
CH2Cl2 |
- |
+ |
+ |
+++ |
+ |
- |
- |
++ |
|
|
MeOH |
- |
- |
- |
+++ |
+ |
- |
++ |
++ |
|
|
Piper umbellatum L./4012 |
n-Hexanos |
- |
+++ |
++ |
++ |
++ |
- |
- |
- |
|
CH2Cl2 |
- |
+ |
++ |
+ |
+++ |
- |
++ |
++ |
|
|
MeOH |
- |
++ |
+ |
+ |
++ |
- |
+ |
++ |
|
|
Piper pesaresanum C. DC./ 3996 |
n-Hexanos |
+++ |
+++ |
+++ |
+++ |
- |
- |
- |
- |
|
CH2Cl2 |
+++ |
++ |
++ |
++ |
++ |
- |
- |
++ |
|
|
MeOH |
++ |
+++ |
+++ |
+++ |
+++ |
- |
- |
++ |
|
|
Peperomia acuminata Ruiz & Pav./4002 |
n-Hexanos |
++ |
+ |
+ |
- |
- |
- |
- |
- |
|
CH2Cl2 |
++ |
++ |
++ |
++ |
++ |
- |
- |
+ |
|
|
MeOH |
+++ |
+++ |
+++ |
++ |
++ |
- |
- |
++ |
|
|
Piper crasssinervium Kunth/4021 |
n-Hexanos |
- |
+++ |
++ |
+++ |
+ |
- |
- |
- |
|
CH2Cl2 |
- |
+ |
++ |
+ |
+ |
- |
- |
++ |
|
|
MeOH |
- |
- |
+ |
- |
+ |
- |
++ |
++ |
|
|
Piper glanduligerum C. DC./4026 |
n-Hexanos |
- |
+ |
+ |
- |
- |
- |
- |
- |
|
CH2Cl2 |
- |
++ |
+ |
+ |
+ |
- |
- |
+ |
|
|
MeOH |
- |
+ |
+++ |
+ |
+ |
- |
++ |
++ |
|
|
Piper daniel-gonzalezii Trel./4051 |
n-Hexanos |
- |
++ |
++ |
+ |
+ |
- |
- |
- |
|
CH2Cl2 |
- |
++ |
++ |
+ |
+ |
- |
- |
++ |
|
|
MeOH |
+ |
+++ |
+ |
+ |
++ |
- |
++ |
+ |
|
|
Piper calceolarium C. DC./4048 |
n-Hexanos |
- |
- |
++ |
+ |
+ |
- |
- |
- |
|
CH2Cl2 |
- |
+ |
++ |
+ |
+ |
- |
- |
+ |
|
|
MeOH |
+ |
- |
+ |
- |
+ |
- |
++ |
++ |
|
|
Controles positivo |
|
Quinina y papave-rina |
Ácido tánico, ácido gálico, catecol |
Colesterol, estigmas-terol, lupeol, β-estradiol y lanosterol |
Digitonina, hecogenina,diosgenina |
Querce-tina, naringe-nina, kaemp-ferol, miricetina, apigenina |
Digitoxina |
Cumarina |
Antraquinona |
(-): Ausencia del núcleo; (+): Presencia del
núcleo; (++): Presencia moderada del núcleo; (+++): Presencia abundante
del núcleo
CH2Cl2=
Diclorometano; MeOH= Metanol.
DISCUSIÓN
Las ocho especies evaluadas presentaron menor actividad antifúngica que antioxidante, es P. eriopodon la más bioactiva, por lo cual se considera promisoria para futuros trabajos investigativos. Esta misma especie, P. eripodon, en un estudio de bioprospección realizado con 18 plantas de la familia Piperaceae, recolectadas en la región central colombiana, fue la más efectiva para combatir la mosca blanca (Trialeurodes vaporariorum), así como las larvas del gusano cogollero del maíz (Spodoptera frugiperda) y el hongo F. oxisporum f.sp lycopersici. En esta misma investigación se aisló el compuesto gibbilimbol B, el cual se consideró como el responsable de la actividad fúngicida.19 En otro trabajo realizado con treinta y dos especies de plantas colectadas en diferentes zonas de Colombia, doce de las cuales pertenecían a la familia Piperaceae, se encontró que el aceite esencial de P. eripodon fue el más citotóxico frente a Artemia franciscana.20
Así mismo, P. umbellatum presentó buena actividad antioxidante, es una especie con muchos usos medicinales en diferentes regiones del mundo y se ha comprobado que los extractos y sus compuestos puros, tienen actividades biológicas diversas tales como antibacterial, anti-inflamatoria, analgésica, antioxidante, citotóxica, antimalárica, antileishmancida, antitripanosoma, entre otras.21
En este trabajo, la especie P. daniel-gonzalezii mostró actividad antifúngica moderada frente a los dos hongos evaluados y capacidad antioxidante baja. Estos resultados son opuestos a los encontrados por Cardona y colaboradores,9 quienes evaluaron la actividad antioxidante, leishmanicida y citotóxica de extractos de hexano y etanol; así como fracciones cromatográficas de este último solvente y reportaron que el extracto de etanol y sus fracciones evidenciaron alta capacidad reductora, mientras que la actividad leishmanicida sólo la presentaron los extractos crudos. Esta discrepancia en los resultados puede deberse al estadio metabólico o a las condiciones fisiológicas de la planta asociadas a los factores climáticos, hidrológicos, edáficos, altitudinales, disponibilidad de nutrientes, luminosidad, al momento de la colecta, entre otras.22,23 Por ejemplo, Chaves y coaboradoresl24 reportaron diferencias en la actividad microbiana de Guapira graciliflora y Pseudobombax marginatum, esta divergencia fue justificada por la variación en la concentración de fenoles totales y flavonoides extraídos de las plantas en época lluviosa y en temporada seca.
La especie reportada en este estudio con mayor actividad antifúngica, P. pesaresanum, también presentó inhibición alta de la germinación de las ascosporas de Micosphaerella fijiensis Morelet en su fase sexual, con valores del 96 y del 100 % para los extractos de diclorometano y metanol al respecto. El extracto de diclorometano de esta misma variedad, presentó un IC50= 468,84 mg/L frente a la bacteria Staphylococcus aureus.25 Además, el extracto metanólico de P. crasinervum presentó actividad antioxidante y antifúngica moderada contra F. solani; de esta familia se han obtenido diferentes compuestos con actividades tales como tripanocida, antioxidante y antifúngica.26-28
En este trabajo el metanol fue, el solvente con el que se obtuvieron los mejores resultados tanto en la evaluación de la actividad antioxidante como en la antifúngica. Esto concuerda, con el hecho de que el metanol es un solvente polar con el cual es posible extraer moléculas con mayor grado de polaridad, tales como flavonoides y taninos; responsables en muchos casos de la actividades biológicas que presentan las plantas.12 Sin embargo, es reconocido que la actividad sinergista de los componentes fitoquímicos de un extracto crudo puede justificar la bioactividad de este.29
Los ensayos realizados permiten concluir que la especie P. eripodon fue la de mayor bioactividad. Un fraccionamiento biodirigido de esta especie, con el interés de separar e identificar los metabolitos secundarios responsables de las actividades biológicas evaluadas, será objeto de futuros estudios.
AGRADECIMIENTOS
A la Universidad Tecnológica de Pereira (UTP) y al Centro de Excelencia CIEBREG por el apoyo financiero. A la Corporación Autónoma Regional de Risaralda (CARDER), por conceder el permiso para colectar el material vegetal.
REFERENCIAS BIBLIOGRÁFICAS
1. Lang G, Mayhudin NA, Mitova MI, Sun L, Van Der Sar S, Blunt JW, et al. Evolving trends in the dereplication of natural product extracts: New methodology for rapid, small-scale investigation of natural product extracts. J Nat Prod. 2008;71(9):1595–99.
2. Zhi-Lin Y, Chuan-Chao D, Lian-Ging D. Regulation and accumulation of secondary metabolites in plant-fungus symbiotic system. Review. Afr J Biotechnol. 2007;6(11):1266-71.
3. Newman DJ, Cragg GM. Natural products as sources of new drugs over the 30 years from 1981 to 2010. J Nat Prod. 2012;75(3):11−35.
4. Mi-Bo K, Jae-Sung P, Sang-Bin L. Antioxidant activity and cell toxicity of pressurised liquid extracts from 20 selected plant species in Jeju, Korea. Food Chem. 2010;122(3):546–52.
5. Davies J. Microbes have the last word. A drastic re-evaluation of antimicrobial treatment is needed to overcome the threat of antibiotic-resistant bacteria. EMBO Rep. 2007;8(7):616-21.
6. Clouatre DL. Kava kava: examining new reports of toxicity. Toxicol Lett. 2004;150(1):85-96.
7. Parmar VS, Jain SC, Bisht KS, Jain R, Tajeda P, Jha A, et al. Phytochemistry of the genus Piper. Phytochemistry. 1997;46(4):597–673.
8. Dyer LA, Palmer AND, Editores. Piper: A model genus for studies of phytochemistry, ecology, and evolution. New York: Kluwer Academic / Plenum Publishers; 2004.
9. Cardona W, Robledo SM, Rojano BA, Alzate F, Muñoz DL, Saez J, et al. Actividad leishmanicida y antioxidante de extractos de Piper daniel-gonzalezii Trel. (Piperaceae). Rev Cubana Plant Med. 2013;18(2):268-77.
10. Lopes AP, Bagatela BS, Rosa PSP, Nanayakkara DNP, Tavares JC, Maistro EL, et al. Antioxidant and Cytotoxic Effects of Crude Extract, Fractions and 4-Nerolidylcathecol from Aerial Parts of Pothomorphe umbellata L. (Piperaceae). BioMed Res Int. 2013;Article ID 206581-5.
11. Tsofack F, Parvez M, Hubert J, Deepshikha T, Dimo T, Kamtchouing P, et al. Ethanol extract of Peperomia pellucida (Piperaceae) promotes fracture healing by an anabolic effect on osteoblasts, J Ethnopharmacol. 2013;148(1):62-8.
12. Mutee AF, Sashimi SM, Yam MF, Lim CP, Abdullah GZ, Ameer OZ, et al. In vivo anti-inflammatory and in vitro antioxidant activities of Peperomia pellucida. Int J Pharmacol. 2010;6(5):686-90.
13. Ahmad N, Fazal H, Haider B, Farooq S, Ali M. Biological role of Piper nigrum L. (Black pepper): A review. Asian Pac J Trop Biomed. 2012;S1945-53.
14. Chakraborty D, Shah B. Antimicrobial, antioxidative and antihemolytic activity of Piper betel leaf extracts. Int J Pharm Pharm Sci. 2011;3 (Suppl 3):192-99.
15. Niño J, Correa Y, Mosquera O. Antibacterial, antifungal, and cytotoxic activities of 11 Solanaceae plants from Colombian biodiversity. Pharm Biol. 2006;44(1):14-8.
16. Brand–Williams W, Cuvelier M, Berset C. Use of a free radical method to evaluate antioxidant activity. Lebensm-Wiss Technol. 1995;28(1):25-30.
17. Daoubi M, Deligeorgopoulou A, Macias-Sanchez AJ, Hernandez-Galan R, Hitchcock PB, Hanson JR, et al. Antifungal activity and biotransformation of diisophorone by Botrytis cinerea. J Agric Food Chem. 2005;53(15):6035-39.
18. Wagner H, Bladt S. Plant drug analysis. A thin layer chromatography atlas. 2 ed. Berlin: Springer; 1996.
19. Muñoz DR. Estudio fitoquímico y evaluación de la actividad fungicida e insecticida de la especie Piper eriopodon (Piperaceae). (Tesis de grado). Bogotá: Universidad Nacional de Colombia; 2008.
20. Olivero J, Güette J, Stashenko E. Acute toxicity against Artemia franciscana of essential oils isolated from plants of the genus Lippia and Piper collected in Colombia. BLACPMA. 2009;8(5):419–27.
21. Roersch CMFB. Piper umbellatum L. A comparative cross-cultural analysis of its medicinal uses and an ethnopharmacological evaluation. J Ethnopharmacol. 2010;131(3):522–37.
22. Kutchan TM. Ecological arsenal and developmental dispatcher. The paradigm of secondary metabolism. Plant Physiol. 2001;25(1):58-60.
23. Gobbo-Neto L, Lopes NP. Plantas medicinais: fatores de influência no conteúdo de metabólitos secundários. Quim Nova. 2007;30(2):374-81.
24. Chaves TP, Santana CP, Véras G, Brandão DO, Felismino DC, Medeiros AC, et al. Seasonal variation in the production of secondary metabolites and antimicrobial activity of two plant species used in Brazilian traditional medicine. Afr J Biotechnol. 2013;12(8):847-53.
25. Giraldo A. Estudio fitoquímico de Piper pesaresanum y Piper crassinervium (piperaceae). (Trabajo de grado). Pereira: Universidad Tecnológica de Pereira; 2012.
26. López AA, López SN, Regasini LO, Baptista JM, Ambrósio DL, Kato MJ, et al. In vitro activity of compounds isolated from Piper crassinervium against Trypanosoma cruzi. Nat Prod Res. 2008;22(12):1040–46.
27. Yamaguchi LF, Lago JHG, Tanizaki TM, Di Mascio P, Kato MJ. Antioxidant activity of prenylated hydroquinone and benzoic acid derivatives from Piper crassinervium Kunth. Phytochemistry. 2006;67(16):1838–43.
28. Danelutte AP, Lago JHG, Young MCM, Kato MJ. Antifungal flavanones and prenylated hydroquinones from Piper crassinervium Kunth. Phytochemistry. 2003;64(5):555–9.
29. Hendriks M, Cruz-Juarez L, De Bont D, Hall R. Preprocessing and exploratory analysis of chromatographic profiles of plant extracts. Anal Chim Acta. 2005;545(1):53–64.
Recibido: 3 de
diciembre de 2013.
Aprobado: 8 de
febrero de 2015.
Yaned Milena
Correa Navarro. Grupo de Biotecnología-Productos Naturales. Universidad
de Caldas. Manizales, Colombia.
Correo electrónico:
yaned.correa@ucaldas.edu.co