ARTÍCULO ORIGINAL
Efeito das cápsulas de camu-camu sobre a glicemia e o perfil lipídico de adultos saudáveis
Efecto de las cápsulas de camu-camu en la glucemia y perfil lipídico de los adultos sanos
Effect of camu-camu capsules on blood glucose and lipid profile of healthy adults
MSc. Bianca Languer Vargas,I MSc. Flávia Amaro Gonçalves,I DraC. Lúcia Kiyoko Ozaki Yuyama (em memória),II DraC. Francisca das Chagas do Amaral Souza,II DrC. Jaime Paiva Lopes AguiarII
I Universidade Federal do Amazonas.
II Instituto Nacional de Pesquisas
da Amazônia, Coordenação de Sociedade, Ambiente e Saúde.
RESUMO
Introdução: o camu-camu [Myrciaria
dubia (Kunth) McVaugh] é um fruto exclusivo da região amazônica
que possui teores significativos de antioxidantes, principalmente vitamina C
e flavonóides.
Objetivo: avaliar o efeito de cápsulas
de camu-camu sobre o perfil lipídico e a glicemia de adultos jovens.
Métodos: foram avaliados 18 voluntários
de ambos os gêneros, com idades entre 21 e 35 anos. Os participantes foram
divididos em dois grupos: 1) grupo intervenção, que recebeu diariamente
cápsulas de camu-camu contendo 320 mg de vitamina C; 2) grupo controle,
que recebeu diariamente cápsulas contendo 320 mg vitamina C sintética.
Os valores de vitamina C no plasma, glicemia de jejum e perfil lipídico
foram analisados antes e após a intervenção, que ocorreu por
15 dias. Foi procedida a verificação estatística da diferença
entre as médias de todos os desfechos por meio do Teste t de Student.
Resultados: registrou-se aumento significativo
nos níveis séricos de ácido ascórbico e queda significativa
nos valores de glicemia, colesterol total e HDL-c nos participantes que receberam
cápsulas de camu-camu. Também foi observada redução significativa
no LDL-c. No grupo que recebeu cápsulas de vitamina C sintética houve
diminuição significativa apenas na glicemia de jejum. Em ambos os
grupos de estudo registrou-se tendência de diminuição nos triglicerídeos,
porém sem diferença estatisticamente significativa.
Conclusão: conclui-se que as cápsulas
de camu-camu e apresentaram ação hipolipidêmica e hipoglicemiante
nos voluntários estudados. Tais resultados demonstram o potencial benéfico
da vitamina C e do camu-camu à saúde, apresentando o fruto como uma
excelente fonte desta vitamina.
Palavras-chave: Myrciaria dubia (Kunth) McVaugh, intervenção, vitamina C, glicemia de jejum, LDL-colesterol.
RESUMEN
Introducción: el camu-camu
[Myrciaria dubia (Kunth) McVaugh] es una fruta única de la región
amazónica que tiene importantes niveles de antioxidantes, con especial
vitamina C y flavonoides.
Objetivo: evaluar el efecto de las cápsulas
de camu-camu en el perfil de lípidos y glucosa en la sangre de un grupo
de adultos jóvenes.
Métodos: un total de
18 voluntarios de ambos sexos, con edades entre 21 y 35 años participaron
en el estudio. Fueron divididos en dos grupos; el primer, grupo de intervención,
que recibió cápsulas de camu-camu diarias, que contienen 320 mg de
vitamina C; y el segundo, grupo control, que recibió cápsulas diarias
que contienen 320 mg de vitamina C sintética. La vitamina C en los valores
plasmáticos, glucosa en ayunas y los niveles de lípidos fueron analizados
antes y después de la intervención, que tuvo lugar durante 15 días.
Se realizó la verificación estadística de la diferencia entre
el promedio de todos los resultados a través de la prueba de la t de Student.
Resultados: se registró
un aumento significativo de los niveles séricos de ácido ascórbico
y una disminución significativa de los niveles de glucosa en sangre, colesterol
total y HDL-C en los participantes que recibieron cápsulas de camu-camu.
También se observó una reducción significativa en LDL-C. En el
grupo que recibió cápsulas de vitamina C sintética disminuyó
significativamente sólo en la glucosa en ayunas. En ambos grupos de estudio
se reportó una tendencia a la disminución de triglicéridos, aunque
hay diferencias estadísticamente significativas.
Conclusiones: se concluye que las cápsulas
de camu-camu administradas, mostraron acción hipolipemiante e hipoglucemiante
en los voluntarios del estudio. Estos resultados demuestran el potencial beneficio
de la vitamina C y el camu-camu en la salud, con la fruta como una excelente
fuente de esta vitamina.
Palabras clave: Myrciaria dubia (Kunth) McVaugh, intervención, vitamina C, glucosa, colesterol LDL.
ABSTRACT
Introduction: camu-camu (Myrciaria
dubia [Kunth] McVaugh) is a fruit from the Amazon region that has significant
levels of antioxidants, especially vitamin C and flavonoids.
Objective: this study aimed to evaluate
the effect of capsules of camu-camu in lipid profile and glucose of young adults.
Methods: were evaluated 18 volunteers
of both genders, aged between 21 and 35 years. The volunteers were divided into
two groups: 1) intervention group, which received capsules of lyophilized camu-camu
containing 320 mg of vitamin C; 2) control group, which received capsules containing
320 mg of synthetic vitamin C. The ingestion of capsules was daily for 15 days
and blood samples were collected and analyzed before and after the intervention.
Statistical differences in the levels of vitamin C in plasma, fasting glucose
and lipid profile were verified by means of Student's “t” test.
Results: was recorded significant increase
in serum ascorbic acid and a significant decrease in fasting glucose, total
cholesterol and HDL-cholesterol levels in group that received capsules of camu-camu.
There was also a significant decrease in LDL-cholesterol levels in intervention
group. In control group decreased significantly only the levels of fasting glucose.
In both groups there was a tendency of reduction in triglyceride levels, although
it has not been significant.
Conclusion: it was concluded that the
capsules of camu-camu were more efficient, presenting hypolipidemic and hypoglycemic
action in volunteers studied. These results demonstrate the potential benefit
of vitamin C and camu-camu health, presenting the fruit as an excellent source
of this vitamin.
Key words: Myrciaria dubia (Kunth) McVaugh, intervention, vitamin C, fasting glucose, LDL-cholesterol.
INTRODUÇÃO
As doenças crônicas, como diabetes, doenças cardiovasculares (DCV) e câncer representam atualmente 63 % de todas as mortes no mundo.1 O estresse oxidativo desencadeado pela ação de radicais livres gera lesões em componentes biológicos do organismo humano, que estão diretamente envolvidas na patogênese dessas doenças.2
A elevação dos níveis de lipoproteínas plasmáticas, processo patológico conhecido como dislipidemia, é uma das principais causas desencadeantes da aterosclerose. A aterosclerose é uma doença inflamatória crônica multifatorial que possui como principal causa o excesso de lipoproteínas de baixa densidade (LDL) no plasma.3,4 A formação das placas de ateroma constitui fator desencadeante das DCV, já que eventualmente podem se romper, facilitando a formação de coágulos que poderão provocar eventos como infarto cardíaco e isquemia cerebral. Os principais fatores de risco para estas doenças são dieta inadequada, sedentarismo, tabagismo e consumo excessivo de álcool.4
Embora a dislipidemia seja uma das principais causas de aterosclerose e acidentes cardiovasculares, ela pode ser tratada e prevenida. A redução de 10 % no colesterol total de adultos acima de 40 anos de idade pode resultar em queda de 50 % do risco de ataque cardíaco em cinco anos. Além disso, investimentos em prevenção primária configuram como uma solução eficiente e sustentável para frear a epidemia global das DCV.4 Estudos epidemiológicos têm evidenciando que um consumo regular de frutas e verduras está associado à redução do risco de patologias relacionadas ao estresse oxidativo, como DCV e câncer.5,6
Diversos estudos têm relacionado a ação antioxidante da vitamina C como redutora dos níveis de colesterol.7 Segundo Adams et al.,8 o ácido ascórbico é o antioxidante de maior abundância no plasma, sendo capaz de aumentar a excreção de colesterol e eliminar radicais livres, prevenindo que estes oxidem as partículas de LDL-c. Embora já tenham sido evidenciados resultados promissores, os efeitos fisiológicos da vitamina C no organismo humano necessitam ser melhor avaliados.9,10
O camu-camu [Myrciaria dubia (Kunth) McVaugh] é um fruto amazônico semelhante à jabuticaba (Myrciaria cauliflora) encontrado naturalmente à beira de rios e lagos da região e ainda pouco conhecido no restante do Brasil.11 Os frutos da família Myrtaceae, a qual pertence o camu-camu, tem sido foco de inúmeros estudos por apresentarem significativo conteúdo de substâncias antioxidantes. Trabalhos recentes comprovam o alto teor de vitamina C no camu-camu,12,13 que é considerado até o momento, a maior fonte natural desse micronutriente, apresentando concentrações que podem variar entre 2,000 e 6,500 mg em 100 g de fruto.14,15 Este teor pode ser até sete vezes superior ao encontrado na acerola (Malpighia glabra L.), que é referenciada como alimento fonte de ácido ascórbico.16
Dessa forma, a incorporação do camu-camu a uma dieta equilibrada, rica em fibras e micronutrientes, pode constituir uma alternativa promissora de manutenção da boa saúde, tanto para pessoas saudáveis quanto para as portadoras de DCV. Assim, o objetivo do presente estudo foi avaliar o efeito de cápsulas de camu-camu sobre o perfil lipídico e a glicemia de adultos jovens, na intenção de investigar os possíveis efeitos benéficos do fruto, como uma fonte natural de vitamina C.
MÉTODOS
O presente estudo teve como modelo um protocolo experimental de intervenção do tipo ensaio clínico controlado, não randomizado e duplo-cego, e recebeu parecer favorável a sua realização pelo Comitê de Ética em Pesquisa da Universidade Federal do Amazonas (CEP/UFAM), sob protocolo número 0061.0.115.000-11.
A preparação do material e coleta de dados foi realizada no período de janeiro a junho de 2012. Foram convidados a participar adultos jovens de ambos os gêneros. O recrutamento dos participantes ocorreu em duas instituições de ensino superior de Manaus/AM. Para fazer parte da amostra pesquisada, foram considerados como critérios de inclusão: aceitação da participação no estudo mediante assinatura do Termo de Consentimento Livre e Esclarecido (TCLE); idade superior a 19 anos e inferior a 35; origem étnica não indígena; ausência de gestação e lactação; ausência de tabagismo e etilismo; ausência de uso de medicamentos (exceto anticoncepcional); ausência de uso de suplementos alimentares; ausência de doenças inflamatórias e crônicas; Índice de Massa Corporal (IMC) entre 18,5 e 29,9 Kg/m² e ausência de participação em programas de reeducação alimentar e/ou perda de peso. Foram considerados como perdas aqueles indivíduos que se recusaram a participar da pesquisa e aqueles que desistiram de participar, mesmo após assinado o TCLE.
Casuística
Ao início da intervenção aplicou-se um questionário contendo perguntas pertinentes aos critérios de elegibilidade da amostra, sendo também procedida avaliação nutricional, por meio de coleta de medidas antropométricas e de composição corporal, e coleta de sangue venoso, para análise bioquímica do perfil lipídico, da glicemia de jejum e dos níveis séricos de ácido ascórbico.
Após a seleção da amostra, os indivíduos foram distribuídos por sorteio em dois grupos para que tivesse início a intervenção, que ocorreu durante 15 dias. O primeiro grupo, grupo intervenção (GI), recebeu cápsulas de camu-camu liofilizado e o segundo grupo, grupo controle (GC), recebeu cápsulas de vitamina C sintética. Ambos os grupos ingeriram um total de 320 mg de ácido ascórbico/dia. Para alcançar esse quantitativo, os participantes do GI ingeriram oito cápsulas/dia, cada uma contendo 260 mg de pó de camu-camu. Ao final da intervenção foi colhida nova amostra de sangue para se proceder as análises comparativas da glicemia, do perfil lipídico e dos níveis de ácido ascórbico.
Avaliação Nutricional
A avaliação antropométrica foi realizada por meio de medidas de peso e estatura, que foram aferidas e classificadas segundo os critérios estabelecidos pela Organização Mundial de Saúde (OMS),17 utilizando-se balança digital da marca In Body, modelo R20, com capacidade de 150 Kg e precisão de 100 g, e estadiômetro portátil da marca Altura Exata, com escala máxima de 2,50 m e precisão de 0,1 cm. A avaliação da composição corporal foi realizada em aparelho de bioimpedância elétrica da marca In Body, modelo R20, estando o indivíduo em jejum de 12 horas e posicionado ereto, com os pés descalços e segurando com ambas as mãos o bastão de corrente elétrica do aparelho. Com os índices gerados pela bioimpedância elétrica foi possível estimar os percentuais de massa gorda e massa magra de cada participante e classificá-los de acordo com os valores preconizados pelo National Health and Nutrition Examination Survey III (NHANES III).18
Análise bioquímica do sangue
As coletas de sangue foram efetuadas via punção venosa em um dos braços do indivíduo, estando este em repouso, utilizando torniquete e em jejum de pelo menos 12 horas. Foram coletados 5 mL de sangue a cada coleta, por meio de seringa estéril descartável e o procedimento foi realizado por um profissional treinado (biomédico). Foram avaliados os níveis iniciais (antes da intervenção) e finais (após a intervenção) de glicemia de jejum, colesterol total (CT), LDL-colesterol (LDL-c), HDL-colesterol (HDL-c), triglicerídeos (TG) e ácido ascórbico.
Foram considerados os critérios de normalidade do perfil lipídico segundo as recomendações da Sociedade Brasileira de Cardiologia³ (colesterol total ≤ 200 mg/dL, LDL-colesterol ≤ 160 mg/dL, HDL-colesterol ≥ 50 mg/dL para mulheres e 40 mg/dL para homens e triglicerídeos ≤ 150 mg/dL) e a normalidade da glicemia segundo as recomendações da OMS19 (glicemia de jejum ≤ 100 mg/dL).
As análises de glicemia e perfil lipídico foram efetuadas em autoanalisador Mindray, modelo BS-120 utilizando kits de reagentes da marca Dialab. O LDL-c foi calculado utilizando-se a fórmula de Friedewald.3 A determinação do quantitativo de vitamina C sérica foi realizada por dosagem direta, pelo método fotométrico de Lowry et al.20 modificado por Costa.21
Confecção das cápsulas
Para confecção das cápsulas de camu-camu utilizou-se o fruto desidratado obtido por meio de liofilização da polpa in natura. Para confecção das cápsulas de vitamina C, utilizou-se ácido ascórbico sintético da marca Biotech, com 99,7 % de pureza. O material foi encapsulado e esterilizado em luz ultravioleta durante 15 minutos e embaladas em sacos plásticos estéreis de cor escura, para preservação da estabilidade dos pigmentos fotossensíveis do fruto. As embalagens foram devidamente identificadas de acordo com o conteúdo das cápsulas (camu-camu ou vitamina C sintética) e acondicionadas em freezer, sob temperatura média de -18 ºC, por um prazo máximo de sete dias, até o momento de sua distribuição aos participantes da intervenção.
Armazenamento das informações e análise
dos dados
Todos os dados coletados dos participantes foram preenchidos manualmente em questionários impressos, no momento da coleta. Além dos questionários impressos, as informações foram também armazenadas em planilhas do Microsoft Excel.
Foi considerado como desfecho as variações nos níveis séricos de vitamina C, glicemia, CT, HDL-c, LDL-c e TG após a intervenção. Os resultados foram analisados por protocolo de intervenção (todos os participantes do estudo) e por intenção de tratar (somente os participantes que seguiram corretamente o protocolo). Foi procedida a verificação estatística da diferença entre as médias de todos os desfechos por meio do Teste t de Student, com intervalo de confiança de 95 % e probabilidade de 5 % (p< 0,05), utilizando-se o programa estatístico Instat, versão 3.0.
RESULTADOS
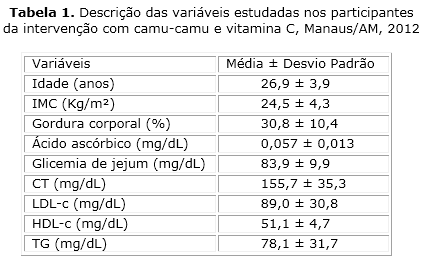
Entre o total de alunos das duas instituições incluídas na pesquisa, 52 aceitaram participar, e destes, 22 se enquadraram nos critérios de seleção da amostra. Quatro indivíduos foram computados como perda, pois desistiram de participar logo ao início da intervenção. Ao todo, 18 voluntários (61 % do gênero feminino, n= 11, e 39 % do gênero masculino, n= 7) fizeram parte da amostra estudada, sendo que 14 seguiram adequadamente o protocolo de intervenção até o final da pesquisa. A tabela 1 apresenta a caracterização dos indivíduos incluídos no estudo.
As médias dos valores de ácido ascórbico, perfil lipídico
e glicemia de todos os voluntários (análise por protocolo), antes
e ao final da intervenção, estão apresentadas na tabela
2. No GI, após 15 dias de intervenção foi evidenciado aumento
significativo nos valores séricos de ácido ascórbico (+ 25,8
%, p< 0,05), reduções significativas na glicemia de jejum (-12,7
%; p< 0,05), no HDL-c (-21,5 %, p< 0,05) e no colesterol total (-19,3
%; p< 0,05) e tendência de diminuição no LDL-c (-19 %; p>0,05)
e nos triglicerídeos (-14,2 %; p>0,05). No GC também observou-se
aumento significativo no ácido ascórbico (+46,4 %, p< 0,05), tendência
de diminuição em todos os biomarcadores estudados, havendo diferença
significativa somente na glicemia de jejum (-13,1 %; p< 0,05).
Ao avaliar-se somente aqueles indivíduos que seguiram corretamente o protocolo de intervenção (análise por intenção de tratar, tabela 3), foi observado, no GI maior aumento no ácido ascórbico sérico (+32,7 %, p< 0,05), redução significativa nos valores de glicemia de jejum (-15,9 %; p< 0,05), colesterol total (-25,0 %; p< 0,05), LDL-c (-26,3 %; p< 0,05) e HDL-c (-24,8 %; p< 0,05) e tendência de diminuição nos valores de triglicerídeos (-18,3 %; p>0,05). No GC também registrou-se maior aumento nos níveis de ácido ascórbico (+49,1 %, p<0,05) e tendência de diminuição em todos os biomarcadores, sendo esta diminuição significativa apenas na glicemia de jejum (-16,7 %; p< 0,05).
DISCUSSÃO
Os resultados encontrados no presente estudo demonstram aumento no ácido ascórbico sérico dos participantes durante o estudo, evidenciando que tanto a vitamina sintética quanto a proveniente do camu-camu foram absorvidas e estiveram disponíveis no plasma sanguíneo. Demonstrou-se também um efeito positivo sobre o perfil lipídico dos participantes, que pode estar relacionado à ação da vitamina C.
Nos resultados comparados entre ambos os grupos de estudo, houve maior efetividade sobre os níveis de colesterol total e LDL-c no grupo que recebeu a vitamina proveniente do camu-camu. Resultado semelhante foi evidenciado por Shingal et al.,22 que realizaram um estudo onde foi avaliado o efeito das vitaminas A, C e E e de frutas in natura variadas sobre os lipídios séricos e os níveis de peroxidação lipídica em adultos com doença cardiovascular. No estudo citado, foi observada diminuição significativa nos valores de CT e LDL-c e aumento no HDL-c apenas entre os participantes que consumiram frutas. Em todos os participantes observou-se diminuição significativa dos níveis de peroxidação lipídica, o que pode promover proteção cardiovascular. Os autores concluíram que tanto a suplementação vitamínica quanto a ingestão de frutas são capazes de auxiliar na redução da peroxidação lipídica. Entretanto, o consumo de frutas promove resultados mais eficientes em relação ao perfil lipídico, provavelmente por apresentarem em sua composição a presença de inúmeros nutrientes benéficos, como fibras, ácidos graxos polinsaturados e flavonóides.
Embora a presente pesquisa tenha sido realizada com indivíduos normolipídicos, a redução significativa nos valores de CT entre os participantes que receberam cápsulas de camu-camu pode ser considerada um resultado promissor para portadores de hipercolesterolemias. Tal resultado assemelha-se ao encontrado por McRae23 que evidenciou, após meta-análise de 51 ensaios clínicos que utilizaram suplementação com vitamina C (na forma sintética ou natural), que esta é capaz de reduzir o CT e que, quanto maiores seus níveis, maior a efetividade desta redução. Dessa forma, o uso de suplementos de vitamina C, pode ser recomendado como auxílio para a redução do CT, principalmente entre pacientes portadores de hipercolesterolemia, ou entre aqueles que possuam consumo inadequado desta vitamina.
A capacidade do ácido ascórbico de reduzir o CT e o LDL-c pode ser explicada, segundo McRae,23 pelo fato deste servir como cofator da enzima hepática α-hidroxilase, responsável pela metabolização do colesterol em ácidos biliares. Pode também exercer papel na remoção das moléculas de LDL-c do plasma, agindo sobre o funcionamento da enzima lecitina colesterol aciltransferase, responsável pela esterificação e sequestro destas moléculas para dentro das HDL-c, aumentando assim a remoção do LDL-c periférico e sua devolução ao fígado. Além disso, devido a sua ação antioxidante, a vitamina C tem demonstrado capacidade de reduzir os níveis de peroxidação lipídica, protegendo as moléculas de LDL-c dos danos oxidativos, o que facilita seu reconhecimento pelos receptores de membrana dos hepatócitos e sua remoção do sangue pelas vias metabólicas normais.
No presente estudo, registrou-se também uma tendência à diminuição dos níveis de triglicerídeos, sendo mais acentuada entre aqueles indivíduos que seguiram corretamente o protocolo de intervenção (em torno de 17 mg/dL ou aproximadamente 14 %), resultado semelhante ao registrado por diversos estudos.22,24,25 Embora discreta e não significativa, essa diminuição pode ser considerada importante, pois pequenas reduções nos níveis de LDL-c e triglicerídeos são suficientes para reduzir o risco de desenvolvimento de DCV, como demonstrado no estudo de coorte “The Atherosclerosis Risk in Communities (ARIC) Study”.26 A pesquisa acompanhou o desenvolvimento de DCV em 12 339 pessoas com idade superior a 45 anos, inicialmente saudáveis, durante 10 anos. Foi evidenciado que uma variação (para mais ou para menos) de 1 mmol/L (aproximadamente 18 mg/dL) no LDL-c ou triglicerídeo, acarreta 40 % de aumento ou diminuição (respectivamente) do risco de desenvolvimento de eventos cardiovasculares como infarto, isquemia e acidente vascular cerebral (AVC), ou seja, os níveis de lipídios sanguíneos são diretamente proporcionais ao risco do surgimento desses eventos. Dessa forma, a redução dos triglicerídeos apresentada pelos participantes do presente estudo, mesmo não sendo significativa do ponto de vista estatístico, pode representar um efeito cardioprotetor, se for permanente. Para tanto, seria necessário que a intervenção aplicada fosse mais longa ou que estes indivíduos mantivessem os níveis de triglicerídeos e LDL-c alcançados durante o estudo através de outros meios, como por exemplo, a prática regular de atividade física e a adoção de uma dieta saudável.
Em ambos os grupos de estudo observou-se, após a intervenção, queda nos níveis séricos de HDL-c. Este resultado mostra-se contrário ao esperado, pois diversas pesquisas já publicadas encontraram associação positiva entre a suplementação com vitamina C e o aumento nos níveis dessa lipoproteína.7,22,27 Alguns estudos de intervenção não encontraram modificações nos níveis de HDL-c após suplementação com ácido ascórbico24,25 e resultado semelhante ao presente estudo foi encontrado por um ensaio clínico que combinou a suplementação com vitaminas C e E em crianças portadoras de hipercolesterolemia familiar. Nessa pesquisa, Aldámiz-Echevarría et al. 28 registraram queda não significativa de 6,4 % nos valores de HDL-c após seis meses de intervenção. Não é possível elucidar ao certo a razão da diminuição nos níveis de HDL-c registrados no presente trabalho, no entanto, o tempo reduzido de intervenção e também o tamanho reduzido da amostra podem ser indicados como prováveis causas, já que não foi realizada intervenção dietética e, em estudos conduzidos com tempo de intervenção maior que 30 dias,22,27 os resultados demonstraram elevação nos níveis desta lipoproteína após o uso suplementar da vitamina C.
Além do impacto benéfico das cápsulas de camu-camu sobre o colesterol total, o LDL-c e os triglicerídeos, foi registrada diminuição significativa de até 15,9 % na glicemia de jejum dos participantes, tanto do GI quanto do GC. Trata-se de uma evidência importante, já que são poucas as pesquisas que relacionam vitamina C à glicemia de pessoas saudáveis.29,30,31 Dakhale et al.32 encontrou resultado similar em um ensaio clínico realizado com pacientes portadores de diabetes tipo 2 em uso de metformina. Os participantes foram divididos em dois grupos, recebendo 500 mg de vitamina C/dia ou placebo, durante 12 semanas. Foi observada redução significativa de 10,4 % na glicemia de jejum dos pacientes que receberam cápsulas de vitamina C, sendo concluído que a vitamina pode ser utilizada como auxiliar para o controle da glicemia durante o tratamento do diabetes tipo 2.
Até o presente momento, nenhum estudo avaliou o efeito do camu-camu, como fonte de vitamina C, sobre os níveis de lipídios plasmáticos em humanos, sendo o presente estudo inédito. Inoue et al.33 realizaram intervenção com camu-camu em seres humanos, no entanto, os autores avaliaram o efeito do suco do fruto (dose relativa a 1050 mg de vitamina C/dia) e da vitamina C sintética (1050 mg/dia) sobre os valores plasmáticos de espécies reativas de oxigênio (ERO), interleucinas (IL), PCRus, TNF-α e Ɣ-interferon. A pesquisa foi conduzida durante sete dias, com 20 homens fumantes. Ao final, foi observado que os participantes que receberam suco de camu-camu apresentaram queda significativa nos valores de PCRus, IL-6, IL-8 e ERO. Mesmo recebendo doses equivalentes da vitamina, os participantes que ingeriram suco de camu-camu obtiveram melhores resultados do que aqueles que receberam somente vitamina C. Segundo os autores, esse fato pode ser explicado pela presença de outras substâncias antioxidantes no fruto além da vitamina C, como flavonóides e antocianinas.
Estudo prévio realizado por Schwertz et al.,34 no INPA, avaliou o efeito do suco concentrado de camu-camu sobre o perfil lipídico de ratos Wistar dislipidêmicos, em comparação à quercetina e a ratos sem tratamento. Foi constatada redução significativa nos níveis de colesterol total, LDL-c e triglicerídeos dos grupos em tratamento, sendo essa redução maior no grupo de cobaias que recebeu 2 mL de suco de camu-camu e no grupo que recebeu 2 mg de quercetina. Foi também controlada a excreção fecal de colesterol. Os ratos que receberam suco de camu-camu ou quercetina padrão apresentaram excreção fecal de colesterol significativamente maior do que aqueles que não receberam nenhum tratamento. Como o camu-camu apresenta concentração relevante de flavonóides, possivelmente estes tenham sido responsáveis pelo aumento da excreção de lipídios pelas fezes, já que possuem ação inibitória sobre a lípase pancreática, enzima responsável pela absorção de ácidos graxos a nível intestinal.34,35 Os autores sugerem que seus resultados podem servir como base para pesquisas da eficiência do fruto sobre o perfil lipídico de humanos. Tais resultados reforçam os achados do presente estudo, evidenciando o potencial do camu-camu como alimento benéfico à saúde. Aliado a hábitos de vida saudáveis, o fruto pode apresentar efeito cardioprotetor, uma vez que pode auxiliar na redução dos valores de glicemia de jejum, CT, LDL-c e triglicerídeos.
CONCLUSÃO
As cápsulas de camu-camu apresentaram ação hipolipidêmica e hipoglicemiante em adultos jovens, reduzindo os níveis de colesterol total, LDL-c e glicemia de jejum e as cápsulas de vitamina C apresentaram apenas ação hipoglicemiante. Tais resultados demonstram o potencial benéfico da vitamina C e principalmente, do camu-camu à saúde, pois as cápsulas do fruto mostraram-se mais eficientes na redução dos níveis de lipoproteínas comparadas ao ácido ascórbico sintético.
A quantidade de 320 mg de vitamina C, utilizada no presente estudo, pode servir como base para estudos em adultos, visto que apresentou efeitos benéficos à saúde dos participantes, sem registro de intercorrências. Neste contexto, o camu-camu configura como uma excelente fonte desta vitamina e também como alternativa para alimentação de pessoas saudáveis ou portadoras de doenças, como dislipidemias e diabetes.
Instituição de financiamento
Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES)
REFERÊNCIAS BIBLIOGRÁFICAS
1. World Health Organization [Internet]. Health Topics. Chronic diseases [acesso 2012 jul 14]. Disponível em: http://www.who.int/topics/chronic_diseases/en/
2. Kim HY, Kim OH, Sung MK. Effects of phenol-depleted and phenol-rich diets on blood markers of oxidative stress, and urinary excretion of quercetin and kaempferol in healthy volunteers. J. Am. Coll. Nutr. 2003;22(3):217-23.
3. Sociedade Brasileira De Cardiologia. IV Diretriz Brasileira sobre Dislipidemias e Prevenção da Aterosclerose. Departamento de Aterosclerose da Sociedade Brasileira de Cardiologia. Arq. Bras. Cardiol. 2007;88(Supl. 1):2-19.
4. World Health Organization; World Heart Federation, World Stroke Organization. Global Atlas on cardiovascular disease prevention and control [Internet]. Geneva: World Health Organization, 2011 [acesso 2012 jan 7]. Disponível em: http://www.who.int/cardiovascular_diseases/publications/atlas_cvd/en/
5. Duthie S, Jenkinson A, Crozier A, Mullen W, Pirie L, Kyle J, et al. The effects of cranberry juice consumption on antioxidant status and biomarkers relating to heart disease and cancer in healthy human volunteers. Nutr. J. 2006;45(2):113-22. doi 10.1007/s00394-005-0572-9.
6. Carlsen MH, Halvorsen BL, Holte K, Bohn SK, Dragland S, Sampson L, et al. The total antioxidant content of more than 3100 foods, beverages, spices, herbs and supplements used worldwide. Nutr. J. [Internet]. 2010 [acesso 2012 jun 12]; 9(3). Disponível em: http://www.nutritionj.com/content/9/1/3
7. Mcrae MP. Vitamin C supplementation lowers serum low-density lipoprotein cholesterol and triglycerides: a meta-analysis of 13 randomized controlled trials. J. Chiropr. Med. 2008;7(1):48-58. doi:10.1016/j.jcme.2008.01.002.
8. Adams AK, Wermuth EO, McBride PE. Antioxidant vitamins and the prevention of Coronary Heart Disease. Am. Fam. Physician. 1999;3(1):895-902.
9. Scalbert A, Williamson G. Dietary Intake and Bioavailability of Polyphenols. J. Nutr. 2000;130(Supl. 8):2073-85.
10. Cerqueira FM, Medeiros MHG, Augusto O. Antioxidantes dietéticos: controvérsias e perspectivas. Quím. Nova. 2007;30(2):441-9.
11. Yuyama K, Yuyama LKO, Valente JP, Silva ACD, Aguiar JPL, Flores WBC, et al. Camu-camu. 1ª ed. São Paulo: Funep, 2010.
12. Ueda H, Kuroiwa E, Tachibana Y, Kawanishi K, Ayala F, Moriyasu M. Aldose reductase inhibitors from the leaves of Myrciaria dubia (H. B. & K.) McVaugh. Phytomedicine. 2004;11(7):652-6. doi:10.1016/j.phymed.2003.12.002.
13. Reynertson KA, Yang H, Jiang B, Basile MJ, Kennelly EJ. Quantitative analysis of antiradical phenolic constituents from fourteen edible Myrtaceae fruits. Food Chem. 2008;109(4):883-90. doi:10.1016/j.foodchem.2008.01.021.
14. Rodrigues RB, Menezes HCD, Cabral LMC, Dornier M, Reynes M. An Amazonian fruit with a high potential as a natural source of vitamin C: the camu-camu (Myrciaria dubia). Fruits. 2001;56(5)345-54.
15. Yuyama K, Aguiar JPL, Yuyama LKO. Camu-camu: um fruto fantástico como fonte de vitamina C. Acta Amaz. 2002;32(1):169-74.
16. Tabela Brasileira de Composição de Alimentos. 4.ª ed., Campinas: NEPA-UNICAMP, 2011.
17. World Health Organization. Physical Status: the use and interpretation of anthropometry. [Internet] Geneva: World Health Organization, 1995 [acesso 2012 jan 23]. Disponível em: http://apps.who.int/bookorders/anglais/detart1.jsp?sesslan=1&codlan=1&codcol=10&codcch=854
18. Centers for Disease control and prevention, National Center For Health Statistics. [Internet] National Health and Nutrition Examination Survey III (NHANES III), 2000 [acesso 2012 jun 29]. Disponível em: http://www.cdc.gov/nchs/nhanes.htm
19. World Health Organization. Definition and diagnosis of diabetes mellitus and intermediate hyperglycemia: report of a WHO/IDF consultation [Internet]. Geneva: World Health Organization, 2006 [acesso 2012 jan 8]. Disponível em: http://www.who.int/diabetes/publications/diagnosis_diabetes2006/en/index.html
20. Lowry OH, Lopez JA, Bessey OA. The determination of ascorbic acid in small amounts of blood serum. Journal of Biological Chemistry. 1945;160(1):609-15.
21. Costa MJC. Statut vitaminique biochimique [pós-doutorado]. Nancy: Université de Nancy, 1992.
22. Shingal S, Gupta R, Goyle A. Comparison of Antioxidant Efficacy of Vitamin E, Vitamin C, Vitamin A and Fruits in Coronary Heart Disease: A Controlled Trial. J. Assoc. Physicians. 2001;49(3):327-31.
23. Mcrae MP. The efficacy of vitamin C supplementation on reducing total serum cholesterol in Human subjects: a review and analysis of 51 experimental trials. J. Chiropr. Med. 2008;5(Supl. 1):2-12.
24. Gokce N, Keaney JF, Frei B, Holbrook M, Olesiak M, Zachariah BJ, et al. Long-term ascorbic acid administration reverses endothelial vasomotor dysfunction in patients with coronary artery disease. Circulation. 1999;99(1):3234-40. doi: 10.1161/01.CIR.99.25.3234.
25. Vinson JA, Jang J. In vitro and in vivo lipoprotein antioxidant effect of a citrus extract and ascorbic acid on normal and hypercholesterolemic human subjects. J. Med. Food. 2001;4(4):187-92.
26. Sharrett AR, Ballantyne CM, Coady SA, Heiss G, Sorlie PD, Catellier D, et al. Coronary heart disease prediction from lipoprotein cholesterol levels, triglycerides, lipoprotein(a), apolipoproteins A-I and B, and HDL density subfractions: The Atherosclerosis Risk in Communities (ARIC) Study. Circulation. 2001;104(10):1108-13. doi: 10.1161/hc3501.095214.
27. Fotherby MD, Williams JC, Forster LA, Craner P, Ferns GA. Effect of vitamin C on ambulatory blood pressure and plasma lipids in older persons. J. Hypertens. 2000;18(4):411-5.
28. Aldámiz-Echevarría L, Dalmau J, Prieto JA, Andrade F, Sanjurjo P, Elorz J, et al. Ensayo aleatorizado ciego-sencillo sobre los efectos de las vitaminas C y E en la hipercolesterolemia familiar. An. Pediatr. (Barc). 2006;65(2):101-7.
29. Szaleczky E, Prechl J, Ruzicska E, et al., Reduction of glycated hemoglobin levels by long term, high dose ascorbic acid supplementation in healthy and diabetic patients. Med. Sci. Monit. 1998;4(2):241-4.
30. Czernichow S, Couthouis A, Bertrais S, Vergnaud AC, Dauchet L, Galan P, et al. Antioxidant supplementation does not affect fasting plasma glucose in the Supplementation with Antioxidant Vitamins and Minerals (SU.VI.MAX) study in France: association with dietary intake and plasma concentrations. Am. J. Clin. Nutr. 2006;84(2):395-9.
31. Fadupin GT, Akpoghor AU, Okunade KA. A comparative study of serum ascorbic acid level in people with and without type 2 diabetes in Ibadan, Nigeria. Afr. J. Med. Med. Sci. 2007;36(4):335-9.
32. Dakhale GN, Chaudhari HV, Shrivastava M. Supplementation of vitamin C reduces blood glucose and improves glycosylated hemoglobin in type 2 Diabetes Mellitus: a randomized, double-blind study. Adv. Pharmacol. Sci. [Internet]. 2011 [acesso 2012 jun 16] 2011(1):1-5. Disponvel em: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3254006/pdf/APS2011-195271.pdf doi:10.1155/2011/195271
33. Inoue T, Komoda H, Uchida T, Node K. Tropical fruit camu-camu (Myrciaria dubia) has anti-oxidative and anti-inflammatory properties. J. Cardiology. 2008;52(2):127-32. doi:10.1016/j.jjcc.2008.06.004.
34. Schwertz MC, Maia JRP, Sousa RFS, Aguiar JPL, Yuyama LKO, Lima ES. Efeito hipolipidêmico do suco de camu-camu em ratos. Rev. Nutr. 2012;25(1):35-44. doi 10.1590/S1415-52732012000100004.
35. Li F, Li W, Fu W, Zhang QE, Koike K. Pancreatic lipase-inhibiting triterpenoid saponins from fruits of acanthopanax senticosus. Chem. Pharm. Bull. 2007;55(7):1087-9.
Recibido: 31 de enero de 2014.
Aprobado: 12 de enero de 2015.
MSc. Bianca Languer Vargas. Av. Efigênio
Salles, nº 2224, ap 208/2B, Aleixo, CEP 69060-020, Manaus/AM, Brasil.
Correo electrónico: nutribiancalv@gmail.com