ARTÍCULO ORIGINAL
Propiedades quimiopreventivas de Passiflora mollissima (Kunth) L. H. Bailey (curuba larga) contra cáncer colorrectal
Colorrectal cancer chemopreventive properties of Passiflora mollissima (Kunth) L. H. Bailey (banana passion fruit)
Ing. Diana Carolina Chaparro R.,I DraCs. María Elena Maldonado Celis,I DraCs. Luz Amparo Urango M.,I DrCs. Benjamín Alberto RojanoIII
I Universidad de Antioquia. Escuela
de Nutrición y Dietética. Medellín, Colombia.
II Universidad Nacional de Colombia,
Sede Medellín. Medellín, Colombia.
RESUMEN
Introducción: passiflora mollissima
(Kunth) L.H. Bailey (curuba larga), es una fruta que contiene compuestos polifenólicos
y alta capacidad reductora, con escaso conocimiento sobre sus beneficios para
prevenir el cáncer colorrectal.
Objetivos: evaluar el efecto del consumo
regular de curuba en la prevención del cáncer colorrectal en un modelo
pre-clínico experimental inducido con azoximetano.
Métodos: la actividad quimiopreventiva
de la curuba se evaluó por conteo de Focos de Criptas Aberrantes en el
colon de ratones. La fruta se administró antes y después de la inducción
de cáncer de colon con Azoximetano. Los contenidos de fenoles, flavonoides
y carotenoides totales se determinaron por métodos espectrofotométricos.
La capacidad antioxidante por los métodos FRAP (Ferric Reducing/Antioxidant
Power), DPPH y ORAC (oxygen radical absorbance capacity).
Resultados: el consumo regular de curuba
tiene efecto dosis-dependiente en la reducción de Focos de Criptas Aberrantes
en el modelo in vivo estudiado. El contenido de fenoles fue: 460,1 mg.
Acido Gálico/100 g de fruta seca; el de favonoides: 1907,6 mg Catequina/100
g de fruta seca, y el de carotenoides: 118,8 mg β -caroteno/100 g fruta
seca. El valor FRAP: 8520,3 mg de ácido ascórbico equivalente/100
g fruta seca, DPPH 60843,1 µmol Trolox Equivalente/100 g fruta seca y ORAC
20962,6 µmol Trolox/100g fruta seca.
Conclusiones: la curuba contiene compuestos
fenólicos y carotenoides, presenta capacidad antioxidante, y reduce la
formación de Focos de Criptas Aberrantes.
Palabras clave: neoplasias de colon, quimioprevención, capacidad antioxidante, passiflora.
ABSTRACT
Introduction: Passiflora mollissima
(Kunth) L. H. Bailey (banana passion fruit), a fruit that contains polyphenolic
compounds and high reducing capacity, with few information about their benefits
on the prevention of colorectal cancer.
Objectives: evaluate the effect of regular
consumption of curuba in the prevention of Colorectal Cancer in a preclinical
experimental model induced with azoxymethane.
Methods: chemopreventive activity of banana
passion fruit was estimated counting Aberrant Crypt Foci in the colon of mice
when the fruit was administered before and after the induction of colon cancer
with the agent azoxymethane. The total phenols, flavonoids and carotenoids content
was determined by spectrophotometric methods. The antioxidant capacity by FRAP
(Ferric Reducing/Antioxidant Power) DPPH and ORAC (oxygen radical absorbance
capacity) methods.
Results: banana passion fruit regular ingesting
has dose-dependent effect on the reduction of Aberrant Crypt Foci in the studied
model in vivo. The phenol content was: 460.1 mg. Gallic acid/100
g dried fruit; the flavonoid content: 1907.6 mg Catechin/100 g of dried fruit,
and carotenoid content: 118.8 mg β -caroteno/100 g dried fruit. FRAP value:
8520.31 mg equivalent/100 g ascorbic acid, DPPH 60843.11 µmol Trolox Equivalent/100g
dried fruit, ORAC 20962.60 µmol Trolox/100g dried fruit.
Conclusions: banana passion fruit
has phenolic and carotenoid compounds, presents antioxidant capacity, and reduces
the formation of Aberrant Crypt Foci.
Key words: colonic neoplasms, chemoprevention, antioxidant capacity, passiflora.
INTRODUCCIÓN
El cáncer colorrectal (CCR) es el más común del sistema digestivo y constituye la principal causa de muerte por este tipo de patologías (8,5 % del total de las muertes por cáncer). En términos de incidencia, es el tercero en hombres y el segundo en mujeres a nivel mundial.1
En la actualidad, la estrategia terapéutica del CCR se basa en la cirugía y una quimioterapia paliativa a base de 5-fluorouracilo, irinotecan, metrotexate, bevacizumab, cetuximab y oanitumumab, todos aprobados por la Food and Drugs Administration (FDA) de los Estados Unidos, debido a su capacidad para prevenir la transformación de las células pre-malignas en adenomas, y al final en carcinoma.
El hecho de que estas drogas pueden llevar a la resistencia en los pacientes, así como toxicidad sistémica significativa,2 ha promovido el desarrollo de nuevas estrategias con agentes quimiopreventivos naturales costo-efectivos en cuanto a su seguridad, efectividad a bajas dosis y fácil obtención; capaces de evitar y/o interferir las etapas tempranas de la carcinogénesis3 en individuos sanos, en riesgo, y limitar la emergencia de nuevas células neoplásicas en pacientes previamente tratados por cáncer.4
Estudios epidemiológicos que muestran un efecto protector de las dietas ricas en frutas y verduras contra el CCR han centrado su atención en la posibilidad de que metabolitos secundarios de origen vegetal puedan ejercer efectos anticarcinogénicos.5,6 Este gran grupo de compuestos, se denomina fitoquímicos, responsables en gran parte del sabor y color de plantas comestibles y bebidas derivadas de ellas; incluyen compuestos fenólicos, flavonoides y carotenoides que se han utilizado para suprimir etapas tempranas y tardías de la carcinogénesis.7
La curuba, es un fruto del cual hay pocos informes en lo referente al valor nutritivo y a sus fitoconstituyentes. Se ha reportado por algunas técnicas (ABTS, DPPH y FRAP) diferencias significativas entre la capacidad antioxidante de la curuba y otras frutas colombianas y ecuatorianas. Además, posee la mayor capacidad reductora comparada con 15 frutas colombianas, usando las técnicas FRAP y midiendo el potencial de ionización por voltametría cíclica.8-10 Estas características la convierten en un fruto con propiedades quimiopreventivas muy potenciales. El objetivo de esta investigación es evaluar el efecto del consumo regular de curuba en la prevención del CCR en un modelo in vivo, cuando la fruta se administró antes y después de la inducción del CCR con el agente carcinógeno azoximetano (AOM).
MÉTODOS
Material vegetal
Las frutas utilizadas pertenecen a la familia Passifloraceae, variedad curuba larga (Passiflora mollissima (Kunth) L. H. Bailey) (municipio Sonsón, Colombia). Una muestra del especimen (voucher N° 02489-Saravia) se conserva en el herbario de la Universidad Nacional de Colombia. Las frutas se clasificaron en verdes, pintonas y maduras según la Norma Técnica Colombiana (NTC)-1262. Luego por medio del colorímetro Color Analyzer Probe, LT Lutron RGB–1002, se obtuvo las coordenadas según el sistema RGB (Red, Green, Blue); estos valores fueron convertidos a escala CIELAB en un convertidor de color en la web: www.workwithcolor.com/color-converter-01.htm. Las frutas maduras fueron seleccionadas, lavadas y desinfectadas (NaClO 100 ppm), escaldadas, despulpadas. La pulpa se almacenó a -18 °C y se deshidrató por liofilización.
Equipos
La deshidratación de la pulpa se realizó en un liofilziador Labconco®. El agua usada en los experimentos fue grado HPLC. Todos los experimentos espectrofotométricos se realizaron en un espectrofotómetro ultravioleta-visible Jenway 6405. La disminución en la intensidad de la fluorescencia medida en el ensayo ORAC se efectuó en un espectrofluorímetro Perkin-Elmer LS-55, Beaconstield, U.K.
Determinación de fenoles totales
Se usó el método de Folin-Ciocalteu.11 Se construyó una curva patrón usando como estándar ácido gálico. Se diluyó el extracto a una concentración en la cual el contenido de fenoles se encontraba dentro del intervalo de la curva patrón. Las lecturas se realizaron a 760 nm. Los resultados son expresados como mg de equivalentes de ácido gálico (GAE) por 100 g de peso seco.12
Determinación de flavonoides
Se empleó el ensayo colorimétrico propuesto por Debnath.13 En breve 25 µL de muestra o solución estándar se mezclaron con agua destilada, solución de nitrato de sodio al 5 % (v/v) y cloruro de aluminio 10 % (v/v). Al final la absorbancia se leyó a 517 nm y el contenido de flavonoides se expresó como mg catequina/100 g de fruta fresca o seca.
Determinación de carotenoides
Se utilizó el método descrito por Biswas et al,14 la muestra se mezcló con acetona fría por 15 min, 4 °C. El precipitado se re-extrajo repitiéndose todo el proceso anterior. Ambos extractos se mezclaron, se filtraron y se determinó la absorbancia a 449 nm. La concentración de carotenoides se determinó por curva de calibración utilizando β-Caroteno como sustancia patrón. Los resultados se expresaron como mg β-Caroteno/100 g fruta seca o fresca.
Determinación de la actividad antioxidante
Método DPPH: 15 la muestra se preparó de acuerdo al método de Kuskoski et al., 2005.16 Después, 5 g de la fruta (completa) se homogenizaron con 25 ml de agua destilada en Ultra-Turrax Brand: IKA-WERK©. El extracto se centrifugó a 3889 g por 10 minutos a temperatura ambiente, se recuperó el sobrenadante y se filtró en papel Wathman N° 4. Esta solución se almacenó a 4 °C hasta el momento de su uso. Para el ensayo DPPH se empleó el método de Brand-Williams et al., 199517 con algunas modificaciones, 10 µL de muestra fueron adicionados a 990 µL de una solución metanólica de DPPH, se valoró la disminución en la absorbancia leída luego de 30 min de reacción a una longitud de onda de 517 nm, y se comprobó el valor con la curva de referencia con Trolox como patrón primario. Los resultados fueron expresados como valores TEAC (µmol Trolox Equivalente/100 g fruta seca).
Método FRAP: del inglés Ferric Reducing/Antioxidant Power, según lo diseñó Benzie et al.,1996.18 Cincuenta µL de muestra, preparada como fue descrito en DPPH, se adicionaron a 900 µL de una solución de FRAP (Tampón ácido acético-acetato de sodio pH 3,4), TPTZ, FeCl3, en proporción (10:1:1), tras la reacción se determinó la absorbancia a una longitud de onda de 593 nm, este valor se comparó con la curva de referencia de ácido ascórbico como patrón, y los resultados fueron expresados como AEAC (Ascorbic Acid Equivalent Antioxidant Capacity: mg de ácido ascórbico/100 g fruta seca).
Método ORAC : del inglés Oxygen Radical Absorbance Capacity. Se empleó el método descrito por Prior et al., 200519 y Romero et al., 2010,20 en breve: 30 μL de la muestra, preparada como fue descrita en DPPH, se adicionó a fluoresceína, PBS y AAPH. Las lecturas se realizaron a una de excitación de 493 nm y 515nm de emisión. El efecto protector del antioxidante es calculado usando las diferencias de áreas bajo la curva de decaimiento de la fluoresceína entre el blanco (reacción en ausencia de la muestra) y la muestra, y se comparó contra la curva del patrón primario Trolox. Los resultados se expresaron como µmol equivalentes de Trolox (TEAC)/100 gramos de de fruta seca.
El valor ORAC se calculó utilizando la siguiente ecuación:21
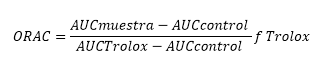
Donde AUC es el área bajo la curva y f es el factor de dilución de los extractos.
Animales de experimentación
Se trabajó con ratones isogénicos de la cepa Balb/C, hembras de 12 semanas de edad, cuyo peso osciló entre 16 y 25 g. Los animales se mantuvieron en cajas separadas con unas dimensiones de (28x17x12) cm, esterilizadas por autoclavado; bajo condiciones controladas de temperatura (18 °C–25 °C) y humedad relativa (50 %-65 %); iluminación artificial con foto-período 12 horas luz y 12 horas oscuridad; con 10-14 recambios de aire/hora con extractores. Transcurrido el tiempo del experimento los ratones fueron insensibilizados con una dosis de 50 µL/ratón de anestésico (solución de 30 mg/mL ketamina, 8 mg/mL xilazina en H2O ultrapura), a continuación la eutanasia se realizó por medio de una dislocación cervical. Los animales se adquirieron en el Bioterio de la Corporación para Investigaciones Biológicas (CIB, Medellín-Colombia) y se mantuvieron según recomendaciones nacionales (Ley 84 de 1989, Res No. 8430 de 1993) e internacionales (Consejo de las Comunidades Europeas y Canadian Council on Animal Care, 1998). Este estudio se efectuó conforme a las reglamentaciones y principios del Comité de Ética para la Experimentación con Animales de la Universidad de Antioquia, Acta número 69 del 28 de junio de 2011.
Modelo experimental
Se realizaron dos experimentos, que se describen a continuación:
Experimento I: los animales se dividieron aleatoriamente en 4 grupos de 8 animales cada uno, durante 3 semanas los animales recibieron ad libitum alimento, agua o curuba reconstituida (0,065 % p/v; 0,13 % p/v; 0,26 % p/v); luego de estas 3 semanas cada grupo fue dividido en 2, y durante las 2 semanas siguientes la mitad de los ratones recibió una dosis semanal de azoximetano (AOM) vía intraperitoneal (ip) (Sigma-Aldrich, Saint-Quentin Fallavier, France) a una concentración de 10 mg/kg de peso; mientras que la otra mitad del grupo recibió inyección ip de solución salina fisiológica; durante estas 2 semanas y por 5 semanas más, los ratones tuvieron libre acceso al alimento, agua o curuba reconstituida (0,065 % p/v; 0,13 % p/v; 0,26 % p/v). Luego de este tiempo los ratones fueron sacrificados.
Experimento II: los ratones recibieron una dosis semanal de AOM durante 2 semanas (como se describe en el experimento I). Luego de estas dos semanas y durante 8 semanas más, los animales fueron separados aleatoriamente en 2 grupos de 6 animales cada uno, un grupo recibió agua ad libitum y el otro grupo curuba reconstituida (0,26 % p/v), después de este tiempo los ratones fueron sacrificados.
Evaluación de Focos de Criptas Aberrantes (FCA)
El análisis de FCA se realizó de acuerdo a Bird.22 En breve, se tomaron aproximadamente 4 cm de la parte más distal del colon de cada animal. Cada segmento fue lavado con solución salina fisiológica, cortado, abierto longitudinalmente y fijado con formalina tamponada al 10 %. Las muestras fueron teñidas con 0,2 % de azul de metileno por 5 min y lavadas con tampón Krebs-Ringer. La lectura se realizó con un objetivo de 10X para identificar la presencia, cantidad y multiplicidad de los FCA. Fueron identificadas como criptas aberrantes aquellas de mayor tamaño, con borde epitelial engrosado y un mayor espacio pericriptal. La multiplicidad cripta se determinó como el número de criptas en cada foco. Las criptas se clasificaron desde una cripta aberrante hasta cuatro o más criptas aberrantes por foco.
Porcentajes de inhibición
Se calcularon como la diferencia del control con cada uno de los tratamientos, o sea:

Análisis estadístico
En el experimento I se usó un diseño completo aleatorizado (DCA) unifactorial para comparar el efecto del suministro de cuatro concentraciones diferentes de curuba larga reconstituida: C1, C2, C3 y C4 (siendo C1= 0 % p/v; C2= 0,065 % p/v; C3= 0,13 % p/v; C4= 0,26 % p/v), sobre la formación de FCA en colon, se llevó a cabo un ANOVA, las diferencias entre los tratamientos fueron analizadas usando un test de Tukey, se empleó para ello el programa R (versión 3.0.2/2013-09-25), con una significación del 95 %. En el experimento II, los datos fueron reportados como media ± deviación estándar. Las comparaciones entre grupo Curuba reconstituida (CR) y grupo agua se hicieron usando la prueba U-Mann Whitney, con un nivel de significación del 95 % (SPSS versión 20).
RESULTADOS
En la inspección de color mecánica, el convertidor virtual de parámetros RGB a escala CIELab arrojó los valores que se presentan en la tabla 1.
Los metabolitos secundarios medidos en la curuba objeto de estudio se consignan en la tabla 2.
La capacidad antioxidante por los métodos DPPH, FRAP y ORAC, medida en
la curuba aquí evaluada se consignan en la tabla 3.
El experimento 1 se realizó para evaluar
la capacidad del consumo regular de curuba para prevenir o reducir la aparición
de FCA en colon de ratones hembras Balb/c, cuando ésta se suministró
previo a la administración del agente AOM. En este experimento las concentraciones
de curuba suministradas correspondieron a porciones equivalentes al consumo
de una curuba aproximadamente 30 g (0,065 % p/v), dos curubas aproximadamente
60 g (0,13 % p/v) y tres a cuatro curubas aproximadamente 90 g (0,26 % p/v),
es esta última la porción recomendada para que una persona de 60 kg
consuma diariamente (tabla 4).
El colon de los animales inyectados con solución salina fisiológica no presentó lesiones preneoplásicas en contraste con el grupo de ratones inyectados con AOM en el cual todos exhibieron lesiones preneoplásicas.
Con una significación del 95 % en el Diseño Completamente Aleatorizado de 1 factor (DCA) se encontró que la concentración de CR de 0,26 % tiene el efecto disminuir la aparición de FCA en el colon distal de los ratones utilizados. Los resultados muestran que la CR disminuyó de manera dosis-dependiente la formación de FCA; así: en los animales que recibieron CR con una concentración de 0,065 % se inhibió en 0,15 %; los que recibieron una concentración de 0,13 % se inhibió en 29,1 %; y con la concentración de CR 0,26 % se presentó la mayor inhibición en el número de FCA (56,4 %) comparados con el grupo control con AOM (p> 0,05). Además, se encontró que en el grupo que recibió la concentración 0,26 % el número de FCA disminuyó en 23,1 unidades promedio en número de FCA con respecto al control en el colon distal de los ratones Balb-C (p> 0,05) por lo que esta concentración fue la seleccionada para desarrollar el experimento 2.
El experimento 2 se realizó para evaluar el efecto del consumo regular de curuba sobre la evolución de los FCA hacia la formación de pólipos adenomatosos, cuando ésta se suministra después de la inducción de lesiones precancerosas con el agente AOM (tabla 5).
En este experimento, todos los ratones inyectados con AOM exhibieron lesiones preneoplásicas, notándose mayor concentración en los ratones que bebieron agua en comparación con los que bebieron curuba reconstituida.
Con una significación del 95 % se encontró que la distribución total de FCA es diferente entre los ratones que sólo consumieron agua y los que consumieron CR, en cuanto a la multiplicidad de criptas por foco se observó una disminución significativa en los focos de dos y cuatro o más criptas en los ratones que recibieron la fruta comparados con el grupo control (Agua + AOM).
DISCUSIÓN
El presente trabajo tuvo como fin estudiar el fruto de la curuba larga (Passiflora mollissima (Kunth) L. H. Bailey) en forma de un liofilizado reconstituido en cuanto al contenido de fitoquímicos y su efecto en el desarrollo de FCA al inicio del proceso carcinogénico o su progresión hacia microadenoma, adenoma o carcinoma en el modelo inducido en el colon de ratones Balb/c con el agente químico AOM.
Varios meta-análisis han reportado una disminución del riesgo de padecer CCR con la ingesta regular de frutas, debido a su contenido de fibra y a sus componentes no nutritivos. La curuba (P. mollissima (Kunth) L. H. Bailey) aquí evaluada, tiene un contenido de metabolitos secundarios: fenoles, flavonoides, carotenoides, similar o mayor al de otras frutas de su género y menor al reportado por Rojano (5012,8±68,2 mg. Acido Gálico/100 g pulpa seca) de la misma fruta;21,23 este contenido puede variar por la genética, los factores ambientales, y está influenciado por la especie, la variedad, el método de cultivo, el clima, el estado de madurez, la época de cultivo, las condiciones de poscosecha y almacenamiento, y por ello puede influenciar la bioactividad de estos componentes.24,25
Cabe resaltar que el contenido de fenoles totales, evaluado por el método Folin Ciocalteu, en la curuba de este estudio, fue mayor en la pulpa fresca que en la pulpa seca. Se ha reportado que éste método sobrestima el contenido de fenoles totales en frutas con alta concentración de vitamina C; pues, contabiliza el L-ácido ascórbico, azúcares reductores y otras sustancias que también forman el complejo azul objeto de esta medición.26 La curuba larga Passiflora mollissima contiene 70 mg de vitamina C/100 g de porción comestible.27
El daño en el ADN juega un papel importante en el desarrollo del cáncer. La producción de especies reactivas del oxígeno (ROS) está implicada en el desarrollo tumoral, pues las reacciones de los radicales libres y el ADN resultan en rupturas de la cadena, en la formación de bases oxidadas así como en varias mutaciones.28 Los metabolitos secundarios presentes en las frutas pueden ejercer un efecto anticancerígeno quelando metales con altos reactivos como el Fe, atrapando especies reactivas del nitrógeno y ROS (incluidos los radicales peróxido, hidroxilo, hidróxido, superóxido). También, pueden ejercer influencia en el sistema de defensa antioxidante modulando la actividad de las enzimas de fase I y fase II que juegan un papel primordial en la prevención del daño al ADN.29-33
Los valores FRAP, DPPH y ORAC hallados para la curuba aquí estudiada, son más altos que los reportados por Botero9 para P. mollissima y más altos que los reportados por Carvajal23 para frutos de su género. Sin embargo, son más bajos que los reportados por Rojano21 para P. mollissima. Estos resultados sugieren que los metabolitos estudiados (fenoles, flavonoides y carotenoides) pueden actuar como antioxidantes por al menos tres mecanismos diferentes que incluyen: donación de electrones, neutralización de un radical evitando su acción oxidante e inhibición de un radical de importancia biológica. Por estas características antioxidantes podría catalogarse a la curuba como un agente de bloqueo, capaz de proteger la mucosa del colon, ya que los compuestos bioactivos aquí analizados pueden pasar al intestino grueso donde entran en contacto directamente con la mucosa del colon y/o pueden ser fermentados por la microbiota, resultando en la producción de numerosos compuestos fenólicos que junto con los carbohidratos fermentables de la fibra de esta fruta, pueden actuar en forma sinérgica y potenciar su capacidad quimioprotectora contra el cáncer colorrectal.34,35
El uso de modelos in vivo como el modelo preclínico de CCR inducido con AOM que se utilizó en este estudio, permitió investigar en poco tiempo el efecto de los metabolitos secundarios (polifenoles, flavonoides y carotenoides) de la curuba en la iniciación de la carcinogénesis colorrectal (Formación de FCA) y la progresión a adenomas y adenocarcinomas; encontrándose que la ingestión regular de por lo menos 3 a 4 unidades de curuba larga (90 g); en forma de un liofilizado reconstituido diariamente con agua destilada, podría contribuir a disminuir el riesgo de padecer CCR, porque disminuyó en 56,4 % la aparición de FCA en ratones Balb-C expuestos al AOM y que la consumieron regular durante cinco semanas.
Además, el consumo regular de curuba larga tiene un efecto inhibidor sobre la formación de adenomas en el colon distal de los ratones estudiados pues tras el sacrificio en la semana 10 del protocolo experimental, no se observó presencia de microadenomas o adenomas.
Este es el primer estudio con curuba en un modelo preclínico de cáncer colorrectal inducido con AOM en roedores que muestra esta fruta como un posible alimento quimiopreventivo y/o quimioprotector en su consumo regular, por su contenido de fenoles, flavonoides y carotenoides, disminución de la formación de FCA e inhibición de la progresión hacia adenomas.
Es importante continuar con la descripción del contenido nutricional y de fitoquímicos presentes en la pulpa de curuba larga ( P. mollissima) que podrían estar involucrados en el carácter quimioprotector de la fruta; de igual forma, profundizar en el mecanismo antioxidante in vivo, describe por ejemplo, el efecto de biomarcadores de estrés oxidativo.
AGRADECIMIENTOS
Al Comité para el Desarrollo de la Investigación (CODI) de la Universidad de Antioquia, código 624/convocatoria de mediana cuantía 2011.
APOYO FINANCIERO
Comité para el Desarrollo de la Investigación (CODI) de la Universidad de Antioquia, código 624/convocatoria de mediana cuantía 2011.
REFERENCIAS BIBLIOGRÁFICAS
1. Internacional Agency for Research on Cancer .GLOBOCAN 2012: Estimated Cancer Incidence, Mortality and Prevalence Worldwide in 2012. [database on the Internet] Francia. [updated 2014; cited 2014 Apr 9]. Available from: http://globocan.iarc.fr/Default.aspx
2. Carethers JM. Systemic treatment of advanced colorectal cancer: Tailoring therapy to the tumor. Ther Adv Gastroenterol. 2008;1:33-42.
3. Surh YJ. Cancer chemoprevention with dietary phytochemicals. Nature Rev. 2003;3:768-780.
4. Amin R, Kucuk O, Khuri FR, Shin DM. Perspectives for cancer prevention with natural compounds. J Clin oncol. 2009;27:2712-25.
5. Béliveau R, Gingras D. Role of nutrition in preventing cancer. Can Fam Phys. 2007;53:1905-11.
6. Marshall JR. Prevention of colorectal cancer: diet, chemoprevention and lifestyle. Gastroenterol Clin North Am. 2008:73-83.
7. Karikas GA. Chemoprevention molecular and biochemical mechanisms involved in cancer control and management. Health science journal. 2011;5(2):8
8. Contreras J, Calderón L, Guerra E, García B. Antioxidant capacity, phenolic content and vitamin C in pulp, peel and seed from 24 exotic fruits from Colombia. Food research international. 2011;44(11):2047-53.
9. Botero ML, Ricaurte SC, Monsalve CE, Rojano BA. Capacidad reductora de 15 frutas tropicales. Scientia Et Technica. 2007;13(33):295-6.
10. Vasco C, Ruales J, Kamal-Eldin A. Total phenolic compounds and antioxidant capacities of major fruits from Ecuador. Food Chem. 2008;111(4):816-23.
11. Singleton VL, Rossi JA. Colorimetry of total phenolics with phosphomolybdicphosphotungstic acid reagents. American J Enology Viticulture. 1965;16:144-58.
12. Naranjo M, Vélez T, Rojano B. Actividad antioxidante de café colombiano de diferentes calidades. Rev Cubana Plant Med. 2011;16(2):164-73.
13. Debnath T, Park P, Debnath N, Samad NB, Park HW, Lim BO. Antioxidant activity of Gardenia jasminoides Ellis fruit extracts. Food Chem. 2011;128(3):697-703.
14. Biswas AK, Sahoo J, Chatli MK. A simple UV-Vis spectrophotometric method for determination of β-carotene content in raw carrot, sweet potato and supplemented chicken meat nuggets. Food Sci Technol. 2011(44):1809-13.
15. Mercado G, De La Rosa L, Wall A, Lopéz JA, Álvarez E. Compuestos polifenólicos y capacidad antioxidante de especias típicas consumidas en México. Nutr Hosp. 2013;28(1):36-46.
16. Kuskoski ME, Asuero AG, Troncoso AM, Mancini-Filho J, Fett R. Aplicación de diversos métodos químicos para determinar actividad antioxidante en pulpa de frutos. Ciência e Tecnologia de Alimentos. 2005;25(4):726-32.
17. Brand-Williams W, Cuvelier ME, Berset C. Use of a free radical method to evaluate antioxidant activity. Lebensmittel Wissenchaft und Technologie. 1995;28(1):25-30.
18. Benzie IFF, Strain JJ. The ferric reducing ability of plasma (FRAP) as a measure of ‘‘Antioxidant Power’’: the FRAP assay. Anal Biochem. 1996;239(1):70-6.
19. Prior RL, Wu X, Schaich K. Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements. Journal Agr Food Chem. 2005; 53(10):4290-302.
20. Romero M, Rojano B, Mella J, Pessoa CD, Lissi E, López C. Antioxidant capacity of pure compounds and complex mixtures evaluated by the ORAC-Pyrogallol Red Assay in the Presence of Triton X-100 Micelles. Molecules. 2010;15(9):6152-67.
21. Rojano BA, Zapata K, Cortes FB. Capacidad atrapadora de radicales libres de Passiflora mollissima (Kunth) L. H. Bailey (curuba). Rev Cubana Plant Med. 2012;17(4):408-19.
22. Bird RP. Observation and quantification of aberrant crypts in the murine colon treated with a colon carcinogen: preliminary findings. Cancer Lett. 1987;37:147-51.
23. Carvajal LM, Turbay S, Rojano B, Álvarez LM, Restrepo SL, Álvarez JM, et al. Algunas especies de Passiflora y su capacidad antioxidante. Rev Cubana Plant Med. 2011;16(4):354-63.
24. Zegbe JA, Serna A, Mena J. Mineral nutrition enhances yield and affects fruit quality of ‘Cristalina’ cactus pear. Sci Hortic. 2014;167:63-70.
25. López A, Fenoll J, Helín P, Flores P. Physical characteristics and mineral composition of two pepper cultivars under organic, conventional and soilless cultivation. Sci Hortic. 2013;150:259-66.
26. Prior RL, Wu XL, Schaich K. Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements. J Agric Food Chem. 2005;53(10):4290-302.
27. Otero L. El cultivo de la curuba. Revista Esso Agrícola. 1988;XLI:11-7.
28. Soobrattee M A, Bahorun T, Aruom OI. Chemopreventive actions of polyphenolic compounds in cancer. Biofactors. 2006;27:19-35.
29. Wang SY, Jiao H. Scavenging capacity of berry crops on superoxide radicals, hydrogen peroxide, hydroxyl radicals, and singlet oxygen. J. Agric. Food Chem. 2000;48:5677-84.
30. Zhang Y, Seeram P, Lee R, Fend L, Heber D. Isolation and identification of strawberry phenolics with antioxidant and human cancer cell antiproliferative properties. J. Agric. Food Chem. 2008;56:670-5.
31. Elisia I, Kitts DD. Anthocyanins inhibit peroxyl radical induced apoptosis in Caco-2 cells. Mol. Cell. Biochem. 2008;312:139-45.
32. Schantz M, Mohn C, Baum M, Richling E. Antioxidative efficiency of an anthocyanin rich bilberry extract in the human colon tumour cell lines Caco-2 and HT-29. J. Berry Res. 2010;1:25-33.
33. Bornsek SM, Lovro Z, Polak T, Vanzo A, Ulrich NP, Abram V, et al. Bilberry and blueberry anthocyanins act as powerful intracellular antioxidants in mammalian cells. Food Chem. 2012;134:1878-84.
34. Johnson IT. New approaches to the role of diet in the prevention of cancers in the alimentary tract. Mutat. Res. 2004;551:9-28.
35. Del Rio D, Borges G, Crozier A. Berry flavonoids and phenolics: bioavailability and evidence of protective effects. Br. J. Nutr. 2010;104(3):67-90.
Recibido: 15 de mayo de 2014.
Aprobado: 5 de enero de 2015.
DraCs. María Elena Maldonado Celis.
Escuela de Nutrición y Dietética. Universidad de Antioquia. A.A. 1226,
Medellín, Colombia.
Correo electrónico: mariaele@quimbaya.udea.edu.co