ARTÍCULO ORIGINAL
Tamizaje fitoquímico de extractos y tinturas al 20 % de la raíz y corteza de Dichrostachys cinerea L. (Marabú)
Phytochemical screening of extracts and 20 % tinctures from root and bark of Dichrostachys cinerea L. (Marabú)
Lic. Sandra Rodés Reyes,I DrC. Dilver Peña Fuentes,II MSc. Robinson Hermosilla EspinosaII
I Universidad
de Ciencias Pedagógicas “Blas Roca Calderío”. Facultad
de Ciencias. Manzanillo, Granma, Cuba.
II Facultad
de Ciencias Técnicas. Centro de Estudio de Química Aplicada. Universidad
de Granma. Bayamo, Granma, Cuba.
RESUMEN
Introducción:
la planta Dichrostachys cinérea L. (Marabú) constituye
una fuente importante de alimento en muchos de los sistemas productivos de ovejas
y cabras, fundamental durante el periodo poco lluvioso. Se emplea de forma tradicional
como antiparasitaria, antifúngica, antiinflamatoria, antiséptica e
hipoglucemiante. Existen reportes acerca del uso de su corteza para el tratamiento
de la elefantiasis y la disentería, así como del uso de la infusión
de la raíz para tratar la sífilis y la gonorrea.
Objetivo:
identificar los metabolitos secundarios de interés biológico presentes
en la especie Dichrostachys cinérea a través, del tamizaje
fitoquímico de los extractos y tinturas obtenidos de la corteza y la raíz.
Métodos:
se recolectaron partes representativas de la planta en la localidad de Barrio
Nuevo, Reparto Céspedes, municipio Manzanillo, provincia Granma, Cuba y
se realizó la identificación con ayuda del especialista y DrC.
Luis Catasús Guerra del Jardín Botánico Cupaynicú, en
el municipio Guisa. La corteza y raíces de la planta se lavaron y desinfectaron,
fueron secadas y se molieron. Posterior se obtuvieron los extractos etéreo,
etanólico y acuoso así como, tinturas al 20 % mediante extracción
asistida por ultrasonido, a los que se les realizaron las pruebas fitoquímicas
y se corroboraron los resultados por cromatografía en capa fina.
Resultados:
el estudio fitoquímico realizado a los diferentes extractos, así como
a las tinturas al 20 % de la corteza y raíz de D. cinerea revela
una amplia diversidad de metabolitos secundarios entre los que resaltan por
su importancia y abundancia las saponinas, alcaloides, cumarinas y taninos,
los cuales son con mayor probabilidad los responsables de las propiedades biológicas
atribuidas.
Conclusiones:
las saponinas, alcaloides, cumarinas y taninos presentes en D. cinerea
pudieran ser los metabolitos responsables de los efectos terapéuticos atribuidos
a esta planta.
Palabras clave: Dichrostachys cinerea, estudio fitoquímico, ultrasonido, extractos, tintura.
ABSTRACT
Introduction:
the plant Dichrostachys cinerea L. (Marabú) is an important
fodder for sheep and goats mainly during the drought period. It is traditionally
used as anti-parasitic, antifungal, anti-inflammatory, antiseptic and hypoglycemic
agent. There are also some reports about the use of the bark for the treatment
of elephantiasis and dysentery. On the other hand root infusions are used to
treat syphilis and gonorrhea.
Objective: to identify the secondary metabolites of biological interest
present in D. cinerea species trough the phytochemical screening of extracts
and tinctures prepared from bark and root.
Methods: representative parts of the plant were collected in the
locality from Barrio Nuevo, Reparto Céspedes, Manzanillo municipality,
Granma province, Cuba and this was identified by PhD. Luis Catasús Guerra,
specialist from Cupaynicú Botanical Garden, Guisa municipality. Bark of
stems and roots were washed, disinfected, dried and ground. Ethereal, ethanolic
and aqueous extracts as well 20% tinctures were prepared later by ultrasound
assisted extraction. A small portion of the extracts was used for the phytochemical
screening and the results were confirmed by TLC by thin-layer chromatography
analysis.
Results:
the phytochemical screening of bark and root extracts and tinctures from
D. cinerea reveals the presence of a great variety of secondary metabolites.
Saponins, alkaloids, coumarins and tannins stand out among all the identified
metabolites as the more important and abundant. They are in all probability
responsible for the biological properties ascribable to D. cinerea.
Conclusions:
saponins, alkaloids, coumarins and tannins present in D. cinerea could
be the metabolites responsible for the therapeutic effects ascribable to this
plant.
Key words: Dichrostachys cinerea, phytochemical screening, ultrasound, extracts, tincture.
INTRODUCCIÓN
En la actualidad las plantas medicinales son más apreciadas que nunca y más del 75 % de la población mundial utilizan las plantas con fines curativos.1 Hay una clara tendencia a la sustitución de los medicamentos sintéticos por fitofármacos, cuyo origen natural inspira una cierta seguridad.2 Entre las plantas utilizadas con fines medicinales en Cuba y aún muy poco examinadas se encuentra el marabú ( Dichrostachys cinerea), perteneciente a la familia de las Fabáceas. Este arbusto constituye un importante alimento en muchos de los sistemas productivos de ovejas y cabras, en lo esencial durante el periodo poco lluvioso.3
En Cuba existe sólo una subespecie, Dichrostachys cinerea L., variedad muy amplia, distribuida en África y se considera la más importante entre las plantas invasoras e indeseables.3 Se han demostrado sus propiedades diuréticas con un comportamiento dosis dependiente.4 La corteza es empleada en lo tradicional para tratar la disentería, el dolor de cabeza y la elefantiasis. La raíz por su parte es utilizada para combatir la sífilis, la gonorrea, la tos y la lepra. También se ha reportado su uso como antihelmíntico y laxante.5-6
A pesar de los usos medicinales que se le dan a esta planta existen muy pocos reportes en la literatura científica que corroboren su utilización como planta medicinal. Resulta además, llamativo que entre las investigaciones realizadas sobre esta planta, aún no se haya reportado un estudio fitoquímico completo de las partes más empleadas con fines medicinales: la corteza y la raíz. En el presente artículo se realizó el tamizaje fitoquímico completo de la corteza y raíz de D. cinerea para identificar los metabolitos secundarios de interés biológico presentes en la especie, responsables de las actividades biológicas atribuidas.
MÉTODOS
Partes de la planta empleada, recolección y desinfección
El material vegetal fue recolectado a partir de plantas en estado adulto en Barrio Nuevo, Reparto Céspedes, Consejo Popular 3 del municipio Manzanillo, provincia de Granma, a las 9:00 a.m. del día 21 de abril del año 2013, a una temperatura de 26 ºC. Fragmentos de raíces, tallo, hojas y flores en conjunto, con fotografías de la planta tomadas en el lugar de recolección se llevaron al Jardín Botánico Cupaynicú, del municipio Guisa, Granma, Cuba para su identificación. Fue realizada por el especialista y DrC. Luis Catasús Guerra, quedó registrada la planta con el número 3034 en el herbario Catasús.7
Las raíces y cortezas recolectadas fueron clasificadas con el objetivo de eliminar la parte del material que no reunía las condiciones óptimas para el estudio, según la NRSP 309 del Ministerio de Salud Pública (MINSAP).8 La biomasa fue sometida entonces a un proceso de desinfección que consistió en lavar con agua potable y posterior inmersión en una disolución de hipoclorito de sodio al 2 %, para asegurar la calidad de la droga desde el punto de vista higiénico sanitario.9
Secado del material
vegetal
Las raíces y cortezas fueron secadas de forma separada durante una semana a la sombra sobre planchas de cartón perforadas, se removió el material dos veces por día. El secado se completó en una estufa (WSU 400, Alemania) con circulación de aire, a 60 ºC durante 3 días. Posterior, fue cortado en fragmentos de 1,0 a 1,5 cm de largo y se pulverizó con un molino eléctrico. Con ayuda de un tamiz circular (TGL 0-4188 WEB, Alemania) se obtuvo una muestra con tamaño de partícula entre 1 mm y 2,5 mm de diámetro.
Preparación
de los extractos
Fueron depositados 5 g del material vegetal seco y pulverizado (raíz/corteza) en un balón de 100 mL y sometidos a extracciones sucesivas utilizando 50 mL de disolventes de polaridad creciente (éter dietílico, etanol al 90 % (v/v) y agua) con ayuda de un baño ultrasónico (SB-3200 DTD, China) a una frecuencia 40 KHz y una temperatura de 22 ºC. El tiempo de extracción fue de 2 h, después del cual se filtró y se continuó la extracción con el próximo solvente.
Preparación
de las tinturas a 20 %
Estuvieron almacenados 60 g del material vegetal seco y pulverizado (raíz/corteza) en un balón de 1000 mL. Se utilizó una solución hidroalcohólica al 70 % (v/v) como menstruo se obtuvieron 300 mL de tintura, se manipuló la extracción por ultrasonido (baño ultrasónico SB-3200 DTD, China) a una frecuencia 40 KHz y una temperatura de 22 ºC durante 2 h.
Preparación
de los extractos secos
Se colocaron 250 mL de tintura al 20 % en un balón de 500 mL y el disolvente fue removido por rotoevaporación a 40 °C y una velocidad de rotación de 60 rpm, se empleó un rotoevaporador (IKA, RV10 Basic, Alemania) conectado a una bomba de vacío (VEM KMR 53 K4 FTH, Alemania).
Análisis
de la composición fitoquímica
A los extractos etéreo, etanólico y acuoso, así como las tinturas al 20 % y extractos secos obtenidos de la corteza y raíz de D. cinerea se les realizó el análisis de la composición fitoquímica, se siguió técnicas sencillas, rápidas y selectivas para la determinación de las diferentes familias de metabolitos secundarios, según el protocolo propuesto por Sandoval,10 Rondina11 y Peña.12
Las tinturas al 20 % y extractos secos fueron sometidas a los mismos ensayos que los extractos etanólicos.
La composición fitoquímica fue corroborada mediante análisis por cromatografía en capa fina. Las corridas se realizaron en placas cromatográficas con soporte de aluminio (Sílica gel 60, F254, espesor 0,2 mm, Merck, Alemania). La detección se efectuó por irradiación con una lámpara de luz ultravioleta (YL WD- 9403E, China) a una longitud de onda de 254 y 365 nm. Dos sistemas de disolvente se usaron para las corridas:
RESULTADOS
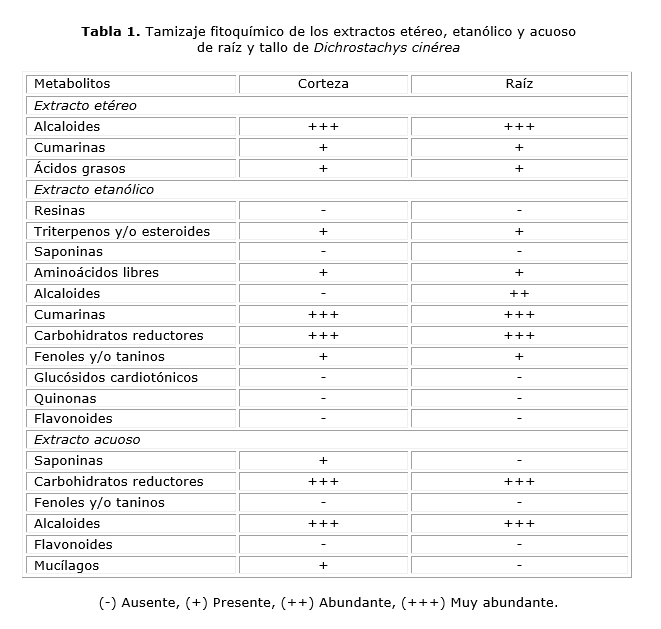
El tamizaje fitoquímico realizado a los extractos etéreo, etanólico y acuoso de la corteza y raíz de D. cinerea reveló la existencia de una amplia diversidad de metabolitos primarios y secundarios de interés farmacológico. En los extractos etéreos resaltan, por su abundancia los alcaloides, y se identifican además, cumarinas y ácidos grasos. En los extractos etanólicos y acuosos se destacan por su mayor concentración las cumarinas y los carbohidratos reductores. Se observa también, taninos y triterpenos en los extractos etanólicos, así como saponinas y mucílagos en el extracto acuoso de la corteza (tabla 1).
Por su parte las tinturas al 20 % de raíz y corteza de D. cinerea
mostraron resultados muy similares en cuanto a su composición fitoquímica,
a los encontrados para los extractos etanólicos, identificándose abundantes
alcaloides en la raíz. El tamizaje fitoquímico de los extractos secos
obtenidos, reveló resultados muy similares a los de las tinturas al 20
% con un incremento en la concentración de alcaloides (tabla
2).
El análisis de la composición fitoquímica mediante cromatografía en capa fina, permitió corroborar los resultados del tamizaje fitoquímico, detectándose la presencia de alcaloides, cumarinas y taninos (Fig. 1 y 2).
DISCUSIÓN
El análisis fitoquímico de los extractos y tinturas obtenidos de tallos y raíces de la planta D. cinerea reveló la presencia de saponinas alcaloides, taninos, cumarinas, y esteroides con diferencias en cuanto a su distribución entre la raíz y la corteza. La presencia de saponinas ha sido reportada también para otras especies de Fabáceas.13,14 Se sabe que estas sustancias de naturaleza anfifílica están constituidas por un núcleo triterpénico o esteroide, unido a uno o varios residuos de monosacáridos (entre 1 y 11 unidades). Su solubilidad depende de la cantidad de residuos de monosacáridos y de los grupos polares presentes en la aglicona.15-18
Resulta interesante que sólo se detectaron saponinas en el extracto acuoso de la raíz, no así en los extractos etanólico y etéreo, lo cual sugiere la alta polaridad de las saponinas presentes en la raíz de D. cinerea (tabla 1). La alta solubilidad de las saponinas encontradas sugiere la presencia de grupos polares en su estructura, así como la presencia de varios residuos de monosacáridos. Los hallazgos discrepan en cierta medida, de los reportados por Omukhulu Neondo y colaboradores,5 quienes detectaron saponinas tanto en la corteza como en la raíz, mediante la extracción con agua caliente. Esto pudiera deberse al aumento de la solubilidad con el aumento de la temperatura y al uso de un método diferente para la identificación de estos metabolitos, pues es conocido que las saponinas se encuentran presentes en muy bajas concentraciones en las plantas.18 La influencia del clima y de diferentes factores fenológicos pudieran así mismo influir en esta diferencia.
La presencia de saponinas en la corteza y no en la raíz detectada en este estudio, pudiera justificar el uso de la corteza y no de la raíz para el tratamiento de la elefantiasis y los dolores de cabeza. Estudios realizados han sugerido las propiedades inmunoestimulantes y analgésicas,19 así como antiinflamatorias5 de esta familia de metabolitos secundarios. Otros investigadores han demostrado la potente actividad antifúngica de estos compuestos,20 lo que sugiere otra posible aplicación para los extractos de esta planta medicinal.
Por otro lado, el tamizaje fitoquímico reveló la presencia de abundantes alcaloides tanto en la raíz, como en la corteza de D. cinerea, y es más abundantes en los extractos etéreo y acuoso, y menos abundantes en los extractos etanólicos, lo que sugiere que la mayor parte de los alcaloides son de baja y alta polaridad al respecto, con menor abundancia de alcaloides de polaridad intermedia (tabla 1). El análisis mediante cromatografía en capa fina de los extractos etéreos mostró manchas de color verde (Rf = 0,52 y 0,43) y azul (0,71) a una longitud de onda de 365 nm, las que corroboran la presencia de alcaloides de baja polaridad (Fig. 1), pues estos últimos aparecen como manchas que fluorescen con colores verde-azul y violeta a 365 nm, según la literatura.21 Estas mismas manchas observadas bajo 254 nm aparecieron como sombras oscuras (inhibición de la fluorescencia) frente al verde claro fluorescente de la placa cromatográfica (Fig. 2), lo cual pudiera sugerir la presencia de alcaloides de tipo indólico, quinólico o isoquinolínicos. 21 Los alcaloides constituyen una familia de metabolitos secundarios muy heterogénea que poseen efectos farmacológicos muy diversos y dentro de los cuales se encuentran numerosos compuestos con actividad antibacteriana, anticancerígena y estimulante del sistema nervioso central. 22 La presencia de estos metabolitos secundarios pudiera justificar el uso de D. cinerea para el tratamiento de enfermedades venéreas, la disentería y la lepra.5
El tamizaje fitoquímico mostró además, la presencia de cumarinas, y resultó mayor su concentración en los extractos etanólicos y en las tinturas al 20 % (tablas 1 y 2). Esto sugiere una polaridad intermedia para estos metabolitos secundarios, por lo que pudiera tratarse de furanocumarinas y piranocumarinas.24 En el análisis cromatográfico de los extractos etanólicos y las tinturas al 20 % de la corteza (Fig. 1b) se observaron manchas fluorescentes de color verde (Rf = 0,40; 0,41 y 0,81) y azul (R f = 0,69), lo cual es característico de este tipo de compuestos.21 Por su lado la cromatografía en capa delgada de los extractos etanólicos y las tinturas al 20 % de la raíz (Fig. 1c) mostró manchas fluorescentes de color verde con valores de R f de 0,31; 0,47 y 0,7, al respecto. La observación a una longitud de onda de 254 nm mostró las esperadas sombras oscuras (inhibición de la fluorescencia) aunque no para todas las manchas (Fig. 2 b y c). Esto pudiera deberse a la baja concentración de estos metabolitos secundarios, pues es conocido que algunos de ellos sólo producen este efecto a altas concentraciones.21
Varios estudios realizados muestran que las cumarinas constituyen potentes agentes antimicrobianos y antivirales,23-25 dentro de las cuales se destacan las piranocumarinas, por su amplio espectro de actividad.26La detección de manchas de color rosado a una longitud de onda de 365 nm en los extractos y tinturas de D. cinerea (Fig. 1) pudiera indicar la presencia de cardenólidos.21
En cuanto a los taninos detectados, resulta llamativa su presencia sólo en los extractos etanólicos, pero no en los extractos acuosos. Estos hallazgos sugieren que estos compuestos polifenólicos poseen una polaridad intermedia, por lo cual podría tratarse de taninos condensados (proantocianidinas), cuya presencia y actividad antihelmíntica in vitro ha sido detectada en las hojas y frutos de D. cinerea, 3 y los que se encuentran con frecuencia en la corteza de muchas plantas.27 La eficiencia de la extracción asistida por ultrasonido,29 hizo que la extracción etanólica agotara el contenido de estos metabolitos en la droga vegetal, no detectándose taninos en la extracción acuosa sucesiva. Es por ello, que el etanol podría elegirse para el aislamiento de estos compuestos a partir de D. cinerea, dada su fácil adquisición y baja toxicidad en comparación con otros disolventes orgánicos.
El análisis de la composición fitoquímica de las tinturas y los extractos secos no mostró a penas diferencias, lo que sugiere la estabilidad de las familias de metabolitos detectados frente a las condiciones de secado. Esto resulta importante para su posterior aislamiento y caracterización. La evaluación de las actividades biológicas aun no examinadas para esta planta, y el aislamiento y caracterización de los posibles principios activos se perfilan como la ruta investigativa a seguir. Con los resultados obtenidos, se tiene en cuenta que las saponinas, alcaloides, cumarinas y taninos pudieran ser los metabolitos responsables de los efectos terapéuticos atribuidos a D. cinerea.
REFERENCIAS BIBLIOGRÁFICAS
1. Satyajit DS, Lutfun N. An Introduction to Natural Products Isolation. En: Satyajit DS, Lutfun N. Natural Products Isolation, Methods in Molecular Biology. 3rd ed. UK: Humana Press Inc. 2012;864:2–3.
2. Jesse WHL, Vederas JC. Drug discovery and natural products: end of an era or an endless frontier? Science. 2009;325:161–65.
3. Arece J, Roche Y, López Y, Molina M. Efecto in vitro del extracto acuoso de Dichrostachys cinerea (L.) Wight & Arn. en el desarrollo de las fases exógenas de estrongílidos gastrointestinales de ovinos. Pastos y Forrajes. 2012;35(3):301–9.
4. Sueiro ML, Ribalta V, González Y, Hernández E. Evaluation of diuretic activity from Dichrostachys cinerea (L.) Wight & Arn. leaves and bark aqueous extracts. VacciMonitor. 2010 [citado 8 Abr 2014];19(2). Disponible en: http://www.finlay.sld.cu/publicaciones/vaccimonitor/Vm2010/vm2010.htm#n5
5. Omukhulu Neondo J, Mweu Mbithe C, Kariuki Njenga P, Wangari Muthuri C. Phytochemical characterization, antibacterial screening and toxicity evaluation of Dichrostachys cinerea. International J. of Med. Plant Res. 2012;1(4):32–7.
6. Roig Mesa JT. Plantas medicinales, aromáticas y venenosas de Cuba. La Habana: Editorial Ciencia y Técnica. 1974;952.
7. Regalado Gabancho L, Ventosa Rodríguez I, Morejón Hernández R. Revisión histórica de los herbarios cubanos con énfasis en las series de especímenes. Rev del Jardín Botánico Nacional. 2008;29:101–38.
8. Cuba. Ministerio de Salud Pública. NRSP No. 309. Medicamentos de origen vegetal: droga cruda. Métodos de ensayos. La Habana: MINSAP; 1992.
9. Carballo C. Desinfección química de Pedilanthus tithymaloides L. Poit. Rev Cubana Plant Med. 2005;10(2):45–9.
10. Sandoval D, Suárez O. Estudio fitoquímico preliminar de detección de alcaloides y saponinas en plantas que crecen en Cuba. Rev Cubana Farm. 1990;24(2):288–96.
11. Rondina RVD, Coussio JD. Estudio fitoquímico de plantas medicinales argentinas (1). Rev Invest Agropec (Serie 2. Biología y Producción Vegetal). 1969;6(2):352–66.
12. Peña A, Torres E. Monografía de Productos Naturales. Granma: Universidad de Granma; 2006.
13. Yesilada E, Bedir E, Çalis I, Takaishi Z, Ohmoto Y. Effects of triterpene saponins from Astralagus species on in vitro cytokine release. J. Ethnopharmacol. 2005;96:71–7.
14. Semmar N, Tomofumi M, Mrabet Y, Lacaille-Dubois M-A. Two new acetylated tridesmosidic saponins from Astralagus armatus. Helv Chim. 2010;93:871–6.
15. Francis G, Kerem Z, Makkar HPS, Becker K. The biological action of saponins in animal systems: A review. British Journal of Nutrition. 2002;88(6):587–605.
16. Tomás ChG, Huamán MJ, Aguirre MR, Barrera TM. Extracción y clasificación de la saponina del Sapindus saponaria L., “boliche”. Rev Per Quím. 2010;13(2):36-9.
17. Macías FA, Guerra JO, Simonet AM, Pérez AJ, Nogueiras Clara. Characterization of three Saponins from a fraction using 1D DOSY as a solvent signal suppression tool. Agabrittonosides E–F. Furostane Saponins from Agave brittoniana Trel. spp. Brachypus. Magn. Reson. Chem. 2010;48:350–5.
18. Majinda RRT. Extraction and Isolation of Saponins. En: Satyajit S, Lutfun N. Natural Products Isolation, Methods in Molecular Biology. 3rd ed. UK: Humana Press Inc. 2012;864:415–6.
19. Naj JJ, Hahn JH, Chung S, Kim YI, Nah SY. Effects of ginsenosides active components of ginseng on capsaicin-induced pain-related behavior. Neuropharmacology. 2000;39:2180–84.
20. Damke E, Tsuzuki JK, Cortez DAG, Ferreira ICP, Bertoni TA, Batista MR, et al. In vivo activity of Sapindus saponaria against azole-susceptible and -resistant human vaginal Candida species. Complementary and Alternative Medicine. 2011;11:35–44.
21. Wagner H, Bladt S. Plant Drug Analysis: A Thin Layer Chromatography Atlas. 2nd ed. Berlin: Springer; 2001:3–353.
22. Cseke LJ, Kirakosyan A, Kaufman PB, Warber SL, Duke JA, Brielmann HL. Natural Products from Plants. 2nd ed. Boca Raton, FL: Taylor & Francis Group; 2006:30–6.
23. Shakeel-u-Rehman, Reehana K, Khursheed A, Raja AF, Shawl AS, Alam MS. Isolation, characterization and antibacterial activity studies of coumarins from Rhododendron lepidotum Wall. ex G. Don, Ericaceae. Braz. J. Pharmacogn. 2010;20(6):886–90.
24. Xiao-Tian L, Wei-Shuo F. Medicinal Chemistry of Bioactive Natural Products. Hoboken, New Jersey: John Wiley & Sons, Inc; 2006:325–51.
25. Smyth T, Ramachandran VN, Smyth WF. A study of the antimicrobial activity of selected naturally occurring and synthetic coumarins. Int J Antimicrob Ag. 2009;33:421–6.
26. Melliou E, Magiatis P, Mitaku S, Skaltosounis AL, Chinou E, Chinou I, et al. Natural and synthetic 2,2-dimethylpyranocoumarins with antibacterial activity. J Nat Prod. 2005;68:78–82.
27. Fraga CG. Plants Phenolics and Human Health: Biochemistry, Nutrition and Pharmacology. Hoboken, New Jersey: John Wiley & Sons Inc; 2010:51–3.
28. Santos-Buelga C, Gonzalez-Manzano S, Dueñas M, Gonzalez-Paramas AM. Extraction and Isolation of Phenolics Compounds. En: Satyajit S, Lutfun N. Natural Products Isolation, Methods in Molecular Biology. 3rd ed. UK: Humana Press Inc. 2012;864:438–9.
Recibido: 7 de
julio de 2014.
Aprobado: 4 de febrero
de 2015.
Dilver Peña
Fuentes. Facultad de Ciencias Técnicas, Centro de Estudio de Química
Aplicada, Universidad de Granma. Dirección: Esperanza 125, e/ 6ta. y 7ma.,
Rpto. Vásquez, Manzanillo, Granma, Cuba.
Correo electrónico:
dilver@udg.co.cu