ARTÍCULO ORIGINAL
Toxicidad aguda tópica e irritabilidad dérmica de la decocción de hojas de Piper auritum Kunth (caisimón de anís)
Acute topical toxicity and dermal irritability of decoction of Piper auritum Kunth (caisimón de anís)
Lic. Marisol López Barreiro, MSc. Ana Ibis García Hernández, MSc. Elisa Boucourt Rodríguez, Lic. Zulema Morejón Rodríguez
Laboratorio Central de Farmacología. "Dr. C. Francisco J. Morón Rodríguez", Facultad de Ciencias Médicas "Dr. Salvador Allende". La Habana, Cuba.
RESUMEN
Introducción:
el Piper auritum Kunth comúnmente conocido como caisimón de
anís, o anisón en algunas regiones del país, es una planta ampliamente
utilizada como antiinflamatorio tópico. Tanto la hoja calentada como la
decocción aplicada sobre la zona dañada son empleadas por la población
con este fin.
Objetivo:
determinar la toxicidad aguda tópica y la irritabilidad dérmica
primaria de la decocción al 50 % de hojas frescas de Piper auritum.
Métodos:
se emplearon hojas frescas colectadas el mismo día del ensayo y se utilizaron
las técnicas descritas en las guías de la Organización para la
Cooperación Económica y el Desarrollo (OECD), la 434 para la
toxicidad dérmica utilizando ratas Wistar, manteniendo la decocción
por 24 horas en contacto con la piel previamente afeitada; el peso de los animales
fue controlado antes, durante y al concluir el experimento. Y la OECD 404 para
la irritabilidad tópica empleando conejos Nueva Zelanda aplicando el extracto
por 4 horas a la zona rasurada.
Resultados:
no se apreciaron signos ni síntomas de toxicidad por la absorción
dérmica en las ratas ni se observó evidencia de edema ni eritema en
los conejos empleados.
Conclusiones:
la decocción al 50 % de Piper auritum Kunth posee un índice
de irritabilidad y una toxicidad dérmica bajas en nuestras condiciones
de ensayo.
Palabras clave: Piper auritum, toxicidad aguda dérmica, irritación dérmica, plantas medicinales.
ABSTRACT
Introduction:
Piper auritum Kunth, commonly known as caisimón de anís
or anisón in some regions of the country, is a plant widely used
as topical anti-inflammatory. To this end, leaves may be warmed up and applied
to the damaged area or a decoction prepared and drunk. Objective:
determine the acute topical toxicity and primary dermal irritability of a 50
% decoction of Piper auritum fresh leaves.
Methods:
fresh leaves collected on the same day of the assay were used to prepare a decoction,
following the techniques described in Guideline 434 of the Organization for
Economic Co-operation and Development (OECD 434) about dermal toxicity in Wistar
rats. Decoction was kept in contact with previously shaved skin for 24 hours.
The weight of animals was controlled before, during and upon completion of the
experiment. OECD Guideline 404 was used for topical irritability in New Zealand
rabbits, applying the extract to a previously shaved area for 4 hours.
Results:
no sign or symptom of toxicity due to dermal absorption was observed in the
rats. Rabbits did not show any evidence of edema or erythema.
Conclusions:
Piper auritum Kunth 50 % decoction has a low irritability and dermal
toxicity rate in our test conditions.
Key words: Piper auritum, acute dermal toxicity, dermal irritation, medicinal plants.
INTRODUCCIÓN
Piper auritum Kunt es una planta originaria de México y muy propagada en Cuba. Se le encuentra con frecuencia en patios y jardines en lugares sombreados y húmedos.1 Es conocida popularmente en nuestro país como caisimón de anís en occidente y anisón en las regiones orientales, y ampliamente utilizada por nuestra población para el alivio de dolores articulares, inflamaciones y gases estomacales.
Esta planta perteneciente a la familia Piparaceae ha sido objeto de muchos estudios tanto de su composición química como de la amplia gama de usos que posee. La mayoría de estos estudios están dirigidos a su aceite esencial del que se sabe que el componente mayoritario es el safrol (71,8 %),2 y para el que se han descritos muchos usos como por ejemplo: antioxidante,2 antiplaguicida,3,4 antileishmaniasis,5 efecto espasmolítico,6 antidermatofítico.7 Se reporta además el efecto antiinflamatorio oral del extracto fluido,8 y aparece un estudio con diferentes métodos de extracción y diferentes solventes (acuoso y etanólico) en el que se reporta actividad antioxidante.9
Dentro de la batería de ensayos de primera barrera se encuentran los estudios de toxicidad a dosis única imprescindibles en la estimación del potencial tóxico de una sustancia, referido como el estudio cuali-cuantitativo de los fenómenos tóxicos y de su aparición en función del tiempo tras la administración de una dosis única de la sustancia o de varias dosis fraccionadas en el transcurso de 24 horas.10
En la búsqueda realizada en la base de datos en Scielo, Pubmed, Lilacs son escasos los reportes de estudios de esta planta y aparecen con otras formulaciones,2-9 no encontramos estudios con extractos acuosos del caisimón a pesar de ser la forma más frecuente en que la usa la población por ser la que está a su alcance. Además se encuentran pocos reportes que estudien la toxicología de esta planta y los encontrados lo hacen de forma oral y estudian el extracto fluido.8,11 Uno de los usos reportados como significativos en nuestro país es la decocción para el alivio de inflamaciones reumáticas tanto por ingestión oral como por aplicación tópica;12 por lo que nos propusimos como objetivo determinar la toxicidad aguda tópica y la irritabilidad dérmica primaria de la decocción al 50 % de hojas frescas de caisimón de anís.
MÉTODOS
Material Vegetal
Se emplearon hojas frescas de Piper auritum Kunth denominada comúnmente caisimón de anís, colectadas al momento de usarse en los terrenos aledaños al bioterio de nuestro laboratorio. Identificadas por la Dra. C. Lérida Acosta y con voucher ROIG 4519. Se realizó una decocción al 50 % en frasco de vidrio tapado dejando en ebullición 5 min, arrojando un valor de sólidos totales de 0,82 %.
Animales
Para la toxicidad aguda dérmica se emplearon ratas Wistar no isogénicas convencionales de aproximadamente 180 g de peso corporal enviadas por el Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB) con su correspondiente certificado de salud. Mantenidas en cajas de poliuretano-T4 en el bioterio del Laboratorio Central de Farmacología, a temperatura de 23 oC, humedad relativa de 50-60 %, un período de luz-oscuridad de 12 h cada uno, con libre acceso a pienso para ratones y ratas ALYCO® CMO 1000 y al agua.
Para la irritabilidad dérmica primaria se emplearon conejos albinos Nueva Zelanda machos de aproximadamente 1,8-2,0 kg, procedentes del mismo centro. Mantenidos en muebles adecuados para la especie, con libre acceso a pienso de mantenimiento de conejos ALYCO® CMO 1400 y al agua.
Ambas especies animales tuvieron un período de adaptación a nuestras instalaciones de cinco días.
Los estudios se realizaron cumpliendo las guías de buenas prácticas13 para el cuidado y uso de animales de laboratorio.14
Ensayo de Toxicidad Aguda Dérmica (TAD)
El estudio se realizó según la propuesta a nueva guía 434 de la OECD (Organisation for Economic Co-operation and Development). Se emplearon 10 ratas Wistar (5 de cada sexo) para cada grupo, se afeitó el lomo de los animales 24 horas antes de comenzar el procedimiento cuidando no dañar la piel, en un área del lomo aproximada de 10 % de la superficie corporal. Se aplicaron 10 mL de la decocción al grupo tratado e igual cantidad de agua destilada al grupo control en el área rasurada, se cubrió la misma con un apósito de gasa y se fijó con esparadrapo. A las 24 horas se retiró la venda limpiando cualquier residuo de esta zona. Durante este tiempo se observaron síntomas y signos clínicos de toxicidad. Se registró el peso de los animales al inicio, a los 7 y 14 días posteriores al experimento. Pasado este tiempo los animales fueron sacrificados por inhalación letal de éter y se realizó estudio macroscópico de los órganos principales.15
Ensayo de irritabilidad dérmica primaria
Veinticuatro horas antes del ensayo los conejos albinos New Zeland machos de aproximadamente 2,0 Kg fueron pelados y afeitados tratando de no erosionar la piel del lomo. Se seleccionaron tres animales con la piel intacta, aplicaron 0,5 mL de la decocción en un área de aproximadamente 6 cm2 de la piel y se cubrió con un parche de gasa sostenido a la piel mediante un esparadrapo no irritante. Los animales fueron separados y mantenidos en cajas de retención, para evitar que estuvieran en contacto con el parche.
Al final del período de exposición 4 horas, se removió la sustancia remanente con agua destilada evitando el daño a la epidermis.16,17
Las lecturas de eritema y edema se hicieron a 1, 24, 48 y 72 horas posteriores a la remoción del parche, evaluándose según las escalas establecidas (tablas 1 y 2) y calculándose el índice de irritación primario (IIP)
El eritema se estableció por visualización y el edema por palpación ligera.
Análisis estadístico
Los datos del peso de los animales expresaron en madia ± desviación estándar y se procesaron por el programa estadístico GraphPad Prism 5. Las diferencias estadísticas entre los grupos se determinaron mediante Análisis de Varianza (ANOVA), seguido de un test de comparación múltiple de Dunn, con una significación de P < 0,05.
RESULTADOS
Ensayo de toxicidad aguda dérmica
La administración tópica a través de parches de la decocción al 50 % de partes aéreas frescas, no causó muerte, ni signos clínicos.
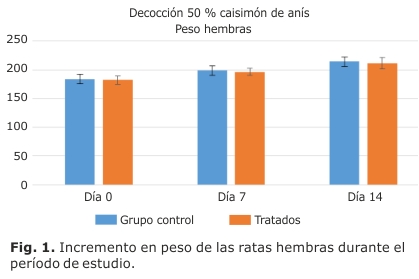
En las figuras 1 y 2 se muestran los resultados de incremento en peso para ambos grupos, no apreciándose diferencias significativas entre los animales tratados y los controles.
Al realizarse la autopsia no se observaron daños macroscópicos en los principales órganos (corazón, pulmones, hígado, bazo, riñones y cerebro).
Ensayo de irritabilidad dérmica primaria
En la evaluación de la irritabilidad dérmica del extracto acuoso al 50 % de hojas de caisimón de anís en los animales tratados no se aprecia ningún daño ni alteración perceptible, obteniéndose un IIP de 0.
DISCUSIÓN
La toxicidad aguda ya sea oral o por absorción dérmica de la sustancia de prueba, tiene por objeto determinar los efectos de una dosis única y muy elevada de una sustancia. Usualmente, el punto final del estudio es la muerte del animal aunque es muy importante la aparición de síntomas o manifestaciones que indiquen daño a la salud del animal de estudio, así como las variaciones de peso de los mismos.
La no aparición de alteraciones en los signos clínicos, con la administración de una sustancia para la evaluación de su efecto agudo, es un factor importante a tener en cuenta, porque las alteraciones del cuadro clínico pueden resultar una clara exposición de posibles alteraciones anatomofisiológicas producidas por la acción tóxica de una sustancia. Esto sería dependiente de varios factores como la duración de la exposición, el grado y la generalización de la lesión, los órganos diana afectados, la cantidad total de la sustancia en sangre, edad y salud general del animal.18
En nuestra investigación de toxicidad aguda e irritabilidad dérmica de la decocción al 50 % de hojas frescas del Piper auritum Kunth no hubo ninguna muerte, ni se apreciaron síntomas y signos de toxicidad, además el índice de irritabilidad fue 0. Lo que se corresponde con otros estudios toxicológicos de esta planta por otras vías de administración y con otros extractos que también han obtenido resultados de baja toxicidad.8,11,12
El peso de los animales en un estudio de toxicidad posee una importancia vital como posible indicador de daño provocado por la sustancia evaluada, por tal motivo, una variación significativa en este indicador sugiere un posible daño orgánico. En este estudio el incremento de peso fue el esperado para la especie, y similar tanto en el grupo tratado como en el control.
En nuestra investigación podemos concluir que la decocción al 50 % de Piper auritum Kunth posee un índice de irritabilidad y una toxicidad dérmica bajas en nuestras condiciones de ensayo.
REFERENCIAS BIBLIOGRÁFICAS
1. Roig JT. Plantas Medicinales, Aromáticas y Venenosas de Cuba. 2da ed. La Habana: Editorial Científico-Técnica; 1992.
2. Rodríguez EJ, Saucedo-Hernández Y, Vander Heyden Y, Simó-Alfonso EF, Ramis-Ramos G, Lerma-García MJ, et al. Chemical analysis and antioxidant activity of the essential oils of three Piperaceae species growing in the central region of Cuba. Nat Prod Commun. 2013 Sep;8(9):1325-8. [citado 2014-10-17]. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/24273877.
3. Delgado E, García-Mateos MR, Ybarra–Moncada MC, Luna-Morales C, Martínez-Damián MT. Propiedades entomotóxicas de los extractos vegetales de Azaradichta indica, Piper auritum y Petiveria alliacea para el control de Spodoptera exigua Hübner. Rev. Chapingo Ser. Hortic [online]. 2012;18(1): 55-69 [citado 2014-10-17]. Disponible en: <http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S1027-152X2012000100004&lng=es&nrm=iso>. ISSN 1027-152X.
4. Sánchez Y, Correa TM, Abreu Y, Pino O. Efecto del aceite esencial de Piper auritum Kunth y sus componentes sobre Xanthomonas albilineans (Ashby) Dowson y Xanthomonas campestris pv. campestris (Pammel) Dowson Rev. Protección Veg. 2013;28(3).
5. Monzote L,García M,Montalvo AM, Scull R, Miranda M. Chemistry, cytotoxicity and antileishmanial activity of the essential oil from Piper auritum. Mem Inst Oswaldo Cruz. 2010 Mar;105(2):168-73. [citado 2014-10-17]. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/20428676
6. Gracia AJ, Martínez MC, Morón F, Pinedo Z. Efecto espasmolítico del aceite de Piper auritum en el músculo liso intestinal. Rev Cubana Plant. Med. [revista en la Internet]. 2001 Abr [citado 2013 Dic 13]; 6(1):19-22. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1028-47962001000100005&lng=es .
7. Hernandéz L, Rodriguez M, Garcia D, Pino J. Actividad antidermatofítica in vitro de aceites esenciales. Rev Cubana Plant Med [revista en la Internet]. 2003; 8(2). [citado 2014 Oct 15]. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1028-47962003000200004&lng=es .
8. Vega R, Lagarto A. Evaluación del efecto antiinflamatorio del extracto de Piper auritum H.B.K. y toxicidad aguda oral. Rev Cubana Plant Med. [revista en la Internet]. 1999 Abr [citado 2014 Oct 15]; 4(1): 11-14. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1028-47961999000100003&lng=es .
9. Conde-Hernández LA , Guerrero-Beltrán JÁ. Total phenolics and antioxidant activity of Piper auritum and Porophyllum ruderale. Food Chem. 2014;1:142 [citado 2014-10-17]. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/24001865
10. Dipascuale L, Wallace H. Acute toxicity and eye irritancy. En: Principles and Methods of Toxicology. 4 ed. Philadelphia: Taylor and Francis, 2001; 4a: 853-917.
11. Blanco N, Ramos A, Vizoso A. Evaluación tóxica y genotóxica del extracto fluido de Piper auritum H.B.K Rev Cubana Plant Med. 2006;11(3-4). [citado 2014 Oct 15]. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1028-47962006000300004&lng=es
12. G-Robineau L. Editor. Farmacopea Vegetal Caribeña 3ra Edición Ampliada y Actualizada TRAMIL 2014. 306-308.
13. Cuba. Para la Protección de la Salud Pública. Principios de las Buenas Prácticas de Laboratorio no Clínico de Seguridad Sanitaria y Medioambiental: Regulación 39/2004. La Habana: El Buró Regulatorio; 2004.
14. EE.UU. National Research Council. Guide for the Care and Use of Laboratory Animals. Washington DC: National Academy Press; 2001.p.21-79.
15. OECD (Proposal of Guideline 434, 14 May 2004, 1st Version OECD GUIDELINE FOR TESTING OF CHEMICALS: Acute Dermal Toxicity – Fixed Dose Procedure) [citado 2014 Oct 15] Disponible en: http://www.oecd.org
16. OECD Acute dermal irritation/corrosion. Guideline for testing chemical. Nº 404 Adoptada 2002. [citado 2014 Oct 15] Disponible en: http://www.oecd.org
17. ISO 10993 Biological Evaluation of Medical Devices. Part. 10. Test for irritation and sensitisation. 2000:8-13.
18. Pérez L, Alfonso A, Fong O, Betancourt J, Salas H, Puente E, et al. Toxicidad a dosis repetida de la decocción de Solanum torvum Sw. (prendejera) en ratas. Rev Cubana Plant Med [revista en la Internet]. 2010;15(2):51-59. [citado 2014 Sep 09]. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1028-47962010000200006&lng=es
Recibido: 17 de
octubre de 2014.
Aprobado:
12 de noviembre de 2014.
Lic. Marisol López Barreiro. Laboratorio Central de Farmacología. "Dr. C. Francisco J. Morón Rodríguez", Facultad de Cencias Médicas "Dr. Salvador Allende", Carvajal entre Agua Dulce y A, Cerro, La Habana, Cuba. CP 12000.
Teléfono: 870-1663. Correo electrónico: marisolb@infomed.sld.cu