ARTÍCULO ORIGINAL
Avaliação da atividade antimicrobiana e moduladora do extrato etanólico de Libidibia ferrea (Mart. ex Tul.) L.P. Queiroz
Evaluación de la actividad antimicrobiana y modulatória del extracto etanólico de Libidibia ferrea (Mart. ex Tul.) L.P. Queiroz
Evaluation of antimicrobial and modulatory activity of the ethanol extract of Libidibia ferrea (Mart. ex Tul.) L.P. Queiroz
João Victor de Alencar Ferreira,I Luciene Ferreira de Lima,I Fernando Gomes Figueredo,I Edinardo Fagner Ferreira Matias,I Elba Sobral de Souza,I Jacqueline Cosmo Andrade,I Saulo Relison Tintino,I Nadghia Figueiredo Leite,I Rosimeire Sabino Albuquerque,I Maria Flaviana Bezerra Morais Braga,I Francisco Assis Bezerra da Cunha,I José Galberto Martins da Costa,II Henrique Douglas Melo CoutinhoI
I Laboratório
de Microbiologia e Biologia Molecular. Universidade Regional do Cariri, Crato
(CE). Brasil.
II
Laboratório de Pesquisas em Produtos Naturais. Universidade Regional do
Cariri, Crato (CE). Brasil.
RESUMO
Introdução:
Staphylococcus aureus é mencionada na literatura como um importante
patógeno, algumas espécimes acarretam infecções oportunistas
em muitos animais e homens. Escherichia coli é uma das principais
causas de doenças infecciosas humanas. Pertencente à família
das Enterobacteriaceae, compartilham diversos fatores de virulência descrita
por sua resistência a vários antibióticos, as contaminações
são provavelmente iniciadas por modificações de defesas do hospedeiro.
Pseudomonas aeruginosaé conhecida por causar infecção
aguda pela produção de toxinas.
Objetivo:
avaliar o efeito antimicrobiano do extrato etanólico de Libidibia
ferrea (Mart. ex Tul.) L.P. Queiroz, e modulação da atividade
antibiótica.
Métodos:
o material botânico de Libidibia ferrea foi coletado no município
de Penaforte, Ceará, Brasil. Para a obtenção dos extratos foram
coletadas entrecasca e vagem frescas, submersos em etanol separadamente por
72 h, sendo após esse período, filtrado e concentrado em condensador
rotativo a vácuo. Foram realizados testes de atividade antimicrobiana e
modulação da atividade antimicrobiana com cepas padrões e multirresistentes
de bactérias.
Resultados:
o extrato demonstrou atividade moduladora quando combinados com alguns
antimicrobianos contra algumas linhagens testadas.
Conclusões:
portanto, é sugerido que o extrato de L. ferrea pode ser utilizada
como uma fonte de produtos naturais na terapêutica antimicrobiana e no
combate a multirresistência bacteriana.
Palavras-chave: Libidibia férrea; atividade antimicrobiana; modificação de resistência.
RESUMEN
Introducción:
Staphylococcus aureus se menciona en la literatura como un patógeno
importante, algunos provocan infecciones oportunistas en animales y hombres.
Escherichia coli es una de las principales causas de enfermedades infecciosas
humanas. Ambas pertenecen a la familia Enterobacteriaceae, comparten muchos
factores de virulencia y se caracterizan por su resistencia a múltiples
antibióticos, su contaminación tal vez iniciada por la modificación
de las defensas del hospedero. Pseudomonas aeruginosa causa de infección
aguda mediante la producción de toxinas.
Objetivo:
evaluar el efecto antimicrobiano del extracto de etanol de Libidibia
ferrea (Mart ex Tul.) LP Queiroz, y la modulación de la actividad antibiótica.
Métodos:
L. ferrea fue recopilada en el municipio de Penaforte, Ceará,
Brasil. Para obtener los extractos se recogieron corteza y frutos frescos, sumergidos
en etanol por separado durante 72 h, después se filtraron y se concentraron
en un condensador rotatorio. Se realizaron pruebas de actividad antimicrobiana
y la modulación de la actividad antimicrobiana con cepas multirresistentes
de bacterias.
Resultados:
los extractos mostraron actividad moduladora cuando se combina con algunos
antibióticos contra algunas cepas ensayadas.
Conclusión:
por lo tanto, se sugiere que el extracto de L. ferrea puede ser
utilizado como una fuente de productos naturales en la terapia antimicrobiana
y en la resistencia a múltiples fármacos bacteriana combate.
Palabras clave: Libidibia férrea; antimicrobiana Atividade; modificação de Resistencia.
ABSTRACT
Introduction:
Staphylococcus aureus is mentioned in the literature as an important
pathogen, some opportunistic bacteria may cause several problems in many animals
and humans. Escherichia coli is a leading cause of human infectious diseases.
Belonging to the family Enterobacteriaceae, share many virulence factors described
by their resistance to multiple antibiotics, the contamination is probably initiated
by modifications in the host defenses. Pseudomonas aeruginosa is known
to cause acute infection by producing toxins.
Objective:
evaluate the antimicrobial effect of the ethanol extract of Libidibia
ferrea (Mart ex Tul.) LP Queiroz, and modulation of antibiotic activity.
Methods:
L. ferrea was collected in the municipality of Penaforte, Ceará,
Brazil. To obtain the extracts were collected bark and fruits, submerged in
ethanol separately for 72 h, after this period, filtered and concentrated in
a rotary vacuum condenser. Antimicrobial activity tests were performed and modulation
of antimicrobial activity with standards and multiresistant strains of bacteria.
Results:
the extract showed antibacterial activity when combined with some antibiotics
against the assayed strains, demonstrating a modulatory potential.
Conclusion:
therefore, it is suggested that L. ferrea extract can be used as
a source of natural products in the antimicrobial therapy and in the combat
bacterial multidrug resistance.
Keywords: Libidibia ferrea; antimicrobial activity; resistance to change.
INTRODUÇÃO
É notório hoje em dia, que as bactérias apresentam a capacidade genética para adquirir e transmitir resistência contra agentes antibacterianos hoje disponíveis.1-3
Bactérias do gênero Staphylococcus são mencionadas na literatura como um importante patógeno devido a fatores como virulência, resistência aos antimicrobianos, distribuição na natureza, assim, como na microbiota normal da pele e da mucosa dos animais e pássaros.4,5 Alguns espécies de Staphylococcus são agentes etiológicos de infecções oportunistas que podem associar-se a patologias sistêmicas fatais, infecções cutâneas, e intoxicação.6,7 Escherichia coli pertence à família das Enterobacteriaceae, bactérias que podem ser encontradas no trato intestinal do homem, ocasiona doenças infecciosas. São conhecidas por produzir enterotoxinas cujas propriedades e seu papel na doença diarréica tem sido amplamente investigado.8 A atividade das citotoxinas e seu papel na infecção humana já foram identificados, principalmente em infecções do trato urinário.9 Patologias causadas por Pseudomonas aeruginosa compreendem desde infecções oportunistas superficiais da pele até septicemia fulminante.10 A P. aeruginosapode causar infecção aguda pela produção de toxinas e infecção crônica pela ação da camada espessa que consiste no agregado chamado biofilme ou ainda em uma patologia que é resultado do somatório destes fatores de virulência.11 Um dos principais agentes causadores de infecções hospitalares, tais como peritonite, bacteremias, infecções do trato urinário e infecções cirúrgicas em indivíduos imunocompetentes.12
Em relação às bactérias patogênicas, uma dificuldade crescente e preocupante é o aumento da resistência bacteriana aos antibióticos. Para pacientes, a resistência antimicrobiana aumenta a morbidade e mortalidade, enquanto que para as instituições de saúde significa aumento de custos, fazendo com às empresas farmacêuticas procuram novas estratégias para abastecer o mercado com novos antimicrobianos.13 Na busca de substâncias para o controle de microrganismos patogênicos, as plantas medicinais têm sido fonte de muitos medicamentos que são aplicados na prática clínica.14
Diversas plantas têm sido analisadas não apenas para confirmar seu potencial antimicrobiano de forma direta, mas também como fontes de substâncias com potencial de serem agentes capazes de modificar a ação antibiótica.15,16 A utilização de extratos como agentes antimicrobianos, apresenta um baixo risco de aumento da resistência microbiana a sua ação, pois são misturas complexas, fazendo com que haja maiores dificuldades para adaptabilidade microbiana.17
A subfamília Caesalpinioideae (Fabaceae) consiste de cerca de 150 gêneros. O gênero Caesalpinia possui cerca 2200 espécies.18-22 espécie antes denominada Caesalpinia ferrea Mart. Hoje em dia chamada de Libidibia férrea (Mart. Ex Tul.) L.P. Queiroz. Conhecida popularmente “porjucá” ou “pau-ferro”, é encontrada em quase todo o Ceará, sendo, porém, mais frequente na Serra do Araripe, Serra do Apodi, parte leste, oeste e sul do estado.23
Estudos farmacológicos registram o uso da L. ferrea como um antifúngico, antimicrobiano, anti-inflamatório e analgésico, indicada para o combate a ulcerações bucais denominadas aftas, bem como o controle de problemas gastrointestinais.24-27 Vagens e raízes da espécie L. ferrea têm sido usadas durante anos, como infusões, para o tratamento de diversos problemas como lesões, reumatismo, hemoptise, febre, enterocolite e a diabetes.28-30 Possuem também inúmeras propriedades terapêuticas que inclui a utilização da entrecasca para o tratamento de feridas, contusões, combate à asma e à tosse crônica.23 Os frutos são antidiarreicos, anticatarrais e cicatrizantes e as raízes são antitérmicas.31
Por tanto, o objetivo deste trabalho foi avaliar o efeito antibacteriano dos extratos e da vagem e a entrecasca da planta e modulação da atividade antibiótica de L. ferrea.
MÉTODOS
Material bacteriano
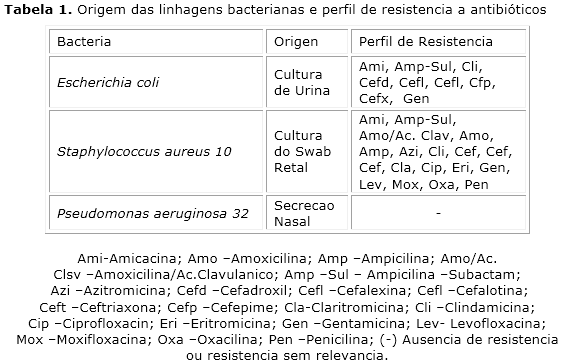
As linhagens bacterianas padrões utilizadas foram S. aureus (ATCC 25293), E. coli(ATCC 25922) e P. aeruginosa (ATCC 9027) e muliressistentes de S. aureus (SA10), E. coli (EC06) e P. aeruginosa (PA 32). Com perfil de resistência apresentado na tabela 1. As bactérias foram reavivadas em meio Heart Infusion Agar (HIA Difco Laboratories Ltda.) e incubadas por 24h a 37 °C em estufa bacteriológica. Todas as linhagens foram adquiridas junto ao Laboratório de Micologia da Universidade Federal da Paraíba – UFPB.
Material Vegetal
O material botânico de L. férrea foi coletado no município de Penaforte, Ceará, Brasil. O material vegetal identificado é da família Fabaceae e foi depositada uma exsicata com nº 10861 no Herbário Dárdano de Andrade Lima – HCDAL da Universidade Regional do Cariri – URCA.
Preparação de extratos etanólicos da entrecasca e vagem da L.
ferrea
As partes coletadas foram trituradas e submersas em solvente etanol 99,9 %, separada em temperatura ambiente por 72 h. Após esse período, a solução obtida foi filtrada e submetida à destilação com solvente no aparelho evaporador rotativo a vácuo (model Q-344B – Quimis, Brazil), onde o produto obtido foi levado ao banho-maria (modelQ-214M2 – Quimis, Brazil), para evaporação do excedente etanólico, obtendo-se rendimentos dos extratos brutos apresentado na tabela 2. A solução utilizada nos testes foi preparada sob uma concentração de 10 mg/mL, dissolvido sem DMSO(dimetilsulfóxido), em seguida diluída com água destilada para uma concentração de 1024 µg/mL.
Drogas
Os antimicrobianos utilizados foram amicacina, gentamicina e clindamicina, todos obtidos do laboratório Sigma Chemical Corp., (St. Louis, MO, EUA).
Atividade antibacteriana (CIM) e modulação da atividade antibiótica
A Concentração Inibitória Mínima (CIM) foi determinada pelo método de microdiluição em caldo.32 O inoculo foi depositado em solução salina para formar uma suspensão de 105 UFC/mL e o ensaio foi realizado em placas de microdiluição com 96 poços, com diluições em série ½.1,33,34. As concentrações finais dos produtos naturais variaram entre 512-8 μg/mL. Para os controles foram utilizados os antibióticos padrões amicacina, gentamicina e clindamicina cujas concentrações finais variaram entre 512 μg/mL-8,0μg/mL.33,34 As placas foram incubadas a 37 ºC por 24 h e após esse período a leitura foi evidenciada pelo uso de Resazurina sódica (Sigma), um indicador calorimétrico de óxido-redução.1 As CIMs foram registradas como as menores concentrações que inibiram o crescimento microbiano.
Para avaliar as amostras como moduladores da ação antibiótica, a CIM dos antibióticos da classe dos aminoglicosídeos e macrolídeos foram avaliadas na ausência e na presença de concentrações subinibitórias dos produtos naturais em microplacas estéreis. Os antibióticos foram avaliados nas concentrações variando de 5000 a 2,5 µg/mL.32,34 Os mesmos controles utilizados na avaliação da CIM para os extratos foram utilizados durante a modulação.1 As placas foram incubadas a 37 ºC por 24 h e após esse período a leitura foi evidenciada pelo uso de Resazurina como citado anteriormente no teste de determinação da CIM. Os ensaios antibacterianos foram realizados em triplicata e os resultados foram expressos como média das repetições.32,34
Análise Estatística
A análise estatística foi realizada através pelo software v4.0 Prisma ™ (GraphPad ® Software, San Diego, Califórnia, EUA). Todos os ensaios químicos foram realizados em triplicata e os dados foram expressos em média geométrica ± erro padrão da média geométrica (EPMg) através da Análise de variância (ANOVA) por uma via pelo teste post hoc de Tukey. Modelos de regressão linear foram gerados para analisar os resultados das Concentrações Efetivas (CE50) e através do coeficiente de Pearson (r), foi avaliada a correlação entre os resultados obtidos neste trabalho. Diferenças em p < 0,05 foram consideradas estatisticamente significativas.
RESULTADOS
As figuras
1 e 2 mostram a CIM dos extratos e o efeito potencializador
em combinação com antimicrobianos. Os extratos etanólicos da
entrecasca e da vagem obtiveram o mesmo resultado de ≥ 1024 µg/mL
para as atividades antibacterianas.32 Na atividade moduladora com
as bactérias, não foi observada modulação estatisticamente
significativa da atividade antibiótica dos produtos naturais sobre a clindamicina,
exceto quando associada ao Extrato Etanólico da vagem de Libidibia férrea
(EEVLF) contra a S. aureus, demonstrando um efeito sinérgico
(Fig. 2).
Quando o Extrato Etanólico da Entrecasca de Libidibia férrea (EEELF) foi combinado com os aminoglicosídios, foi observado sinergismo com a amicacina e gentamicina, observados contra a linhagem SA10 e contra as linhagens gram negativas PA32 e EC06, (Fig. 1). Com relação ao EEVLF, também foi detectado sinergismo entre este produto natural e amicacina quando testados contra a SA10 e EC06. Contudo, este produto interagiu de forma similar ao EEELF contra a PA32, interagindo de forma sinégica apenas com a gentamicina (Fig. 2).
DISCUSSÃO
Hoje em dia há um grande interesse científico em investigações químicas e farmacológicas sobre as propriedades biológicas de plantas medicinais.35 Nesse estudo como pode ser observado, o extrato não teve ação antibacteriana com relevância clínica, resultado semelhante ao observado por,36 apesar de que o mesmo tenha sido feito pelo método de difusão em disco. Entretanto na atividade moduladora sobre a ação antibiótico, foi constatada a atividade sinérgica e antagônica, conforme pode ser visto nas figuras 1 e 2. Com isso, é provável cogitar a utilização das plantas como fontes de novas drogas contra bactérias resistentes aos antimicrobianos tradicionais.37
A atividade sinérgica observada, também pode ser devido à constituição de metabolitos secundários presentes no extrato e nas frações como os taninos, flavonoides e alcaloides que são sintetizados por plantas em resposta a infecções microbianas,38,39 sendo capazes de alterar a parede celular ou destruir a membrana plasmática facilitando absorção das drogas.40,41 Diversas plantas medicinais são utilizadas como uma fonte de muitos antimicrobianos utilizados no tratamento de moléstias infecciosas, incluindo contra bactérias multirresistentes a antibióticos.40
É avaliada a ação sinérgica de produtos naturais junto a antimicrobianos utilizados no tratamento terapêutico, determinando uma diminuição na sua CIM, quando comparado ao controle onde está ausente o produto a ser testado.32-34,41 Quando a substância utilizada na combinação intervém de forma positiva, ou seja, aumentando a atividade do antibiótico, é dito que provoca um efeito sinérgico. Ao contrário, quando há uma diminuição ou inativação da ação dos antibióticos frente à substância ocorrerá o efeito antagônico.42
As concentrações séricas observadas com as doses terapêuticas dos aminoglicosídeos estão próximas das doses tóxicas. A toxicidade celular é característica comum dos aminoglicosídeos (exceto a Estreptomicina), em função de sua absorção para o meio intracelular. Os seus efeitos tóxicos mais importantes são nefrotoxicidade, ototoxicidade e bloqueio neuromuscular.43
A diferença de atividade das amostras na associação com os aminoglicosídeos pode ser devida a diferenças estruturais destes antibióticos que são moléculas hidrofílicas, compostas por um anel aminociclitol central unido a um ou mais amino açúcar através de ligação glicosídica.44 Na maioria destes compostos com utilidade clínica, o grupo aminociclitol é a 2-desoxi-estreptamina, que pode ser dissubstituída na posição 4 e 5, ou 4 e 6.44 Assim podendo intervir na polaridade, solubilidade e absorção destas drogas.
Tanto a amicacina quanto a gentamicina associadas aos EEELF e o EEVLF, frente às bactérias multirrestentes, foram agentes moduladores e potencializadores, possivelmente relacionado ao efeito antioxidante dos flavonoides e fenóis, que é atribuído à propriedade quelante dos mesmos.45
Os efeitos antagônicos e sinérgicos do uso combinado entre antibióticos podem ser atribuído a quelação mútua.46 Torna-se se então importante à descoberta de novos agentes que atuem sinergicamente com estes reduzindo a possibilidade de ocorrência de efeitos indesejáveis.47,48
Portanto, é sugerido que o extrato de L. férrea pode ser utilizado como uma fonte de produtos naturais a fim de auxiliar a sua possível utilização na terapêutica antimicrobiana e no combate à multirresistência bacteriana.
REFERÊNCIAS
1. Leite LH, Tintino SR, Figueredo FG, Oliveira CDM, Siebra ALA, Sampaio RS, et al. Composição química e estudo da atividade antibacteriana de BowdichiaVirgilioidesKunth (Sucupira) - Fabaceae Papilonoidae. Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas. 2014;13:477-87.
2. Nascimento GGF, Locatelli J, Freitas PC, Silva GL. Antibacterial activity of plant extracts and phytochemicals on antibiotic-resistant bacteria. Braz J Microbiol. 2000;31:247-56.
3. Sakagami Y, Kajimura K. Bactericidal activities of disinfectants against vancomycin-resistant enterococci. J Hosp Infec. 2002;50:140-4.
4. Arcuri EF, Brito MAVP, Pinto SM. Qualidade microbiológica do leite refrigerado nas fazendas. Arq. Bras. Med. Vet. Zootec. 2006;(58):440-6.
5. Coutinho HDM, Costa JGM, Siqueira Jr JP, Lima EO. Effect of Momordica charantia L. in the resistance to aminoglycosides in methicilin-resistant Staphylococcus aureus. Comp Immunol Microbiol Infect Dis. 2009;33(6):467-71.
6. Moura FML. Efeito antimicrobiano e antiaderente in vitro de plantas da caatinga frente a microrganismos patogênicos de interesse na área de alimentos. (Dissertação de Mestrado). Universidade Federal Rural de Pernambuco-UFPE. Recife-PE; 2013.
7. Verhoef J, Beaujean D, Blok H, Baars A, Meyler A, Werken VDC, et al. A Ducht approach to methicillin-resistant Staphylococcus aureus. European Journal of Clinical Microbiol & Infectious Diseases. 1999;18(7):461-6.
8. ICMSF. International Committee on Microbiological Specification for Food. Microrganismos de los alimentos: su significado y medotos de enumeracion. Zaragoza: Acribia; 2000. p. 439-40.
9. Germano PML, Germano MIS. Higiene e vigilância sanitaria de alimentos. 4. Ed. São Paulo-SP: Manole; 20001. p. 1033-4.
10. Palleroni NJ. Pseudomonas, classification: a new case history in the taxonomy of gram-negative bacteria. Antonie van Leeuwenhoek, 1993;64(3-4):231-51.
11. Murray PR. Laboratory Procedures for Epidemiologic Analysis. In: Manual of Clinical Microbiology. 6. ed., Washington: ASM Press; 1995.
12. Ferreira H, Lala ERP. Pseudomonas aeruginosa: um alerta aos profissionais de Saúde. Revista Panamericana de Infectologia. 2010;(12):44-50.
13. Chartone-Souza E. Bactérias ultra-resistentes: uma guerra quase perdida. Cienc Hoj. 1998;(23):27-35.
14. Tintino SR, Guedes GMM, Cunha FAB, Santos KKA, Ferreira EFM, Morais-Braga MF, et al. In vitro evaluation of antimicrobial activity and modulating the ethanol and hexane extracts of Costus arabicus bulb. Bioscien J. 2013;29:32-8.
15. Gibbons S. Anti-staphylococcal plant natural products. Nat Prod Rep. 2004;(21):263-7.
16. Gurib–fakim A. Medicinal plants: Traditions of yesterday and drugs of tomorrow. Molecular aspects of medicine. 2006;(27):91-3.
17. Daferera DJ, Ziogas BN, Polissiou MG. The effectiveness of plant essential oils on the growth of Botrytis cinerea, Fusarium sp. And Clavibacter michiganenesis subsp. michiganenesis. Crop Protection. 2003;22(1):39-4.
18. Lewis GP, Schire BD, Mackinder BA, Lock JM. Legumes of the World. Royal Botanic Gardens, Kew; 2005. p. 1-3.
19. Queiroz LP. Leguminosa da caatinga. Feira de Santana, Associação Plantas do Nordeste. Universidade Estadual de Feira de Santana; 2009. p. 443-67.
20. Simpson MG. Plant Systematics. Toronto: Elsevier-Academic Press; 2006.
21. Cronquist A. An integrated system of classification of flowering plants. New York: Columbia University Press; 1981.
22. Cavalheiro MG, Farias DF, Fernandes GS, Nunes EP, Cavalcanti FS, Vasconcelos IM, et al. Biological and enzymatic activities of aqueous extract of seeds from Caesalpinia ferrea Mart. Leguminosae. Revista Brasileira de Farmacognosia. 2009;(19):586-91.
23. Maia GN. Caatinga: árvores e arbustos e suas utilidades. São Paulo-SP, D&Z Computação Gráfica, Leitura & Arte; 2004. p. 413-4.
24. Vieira LS. Fitoterapia da Amazônia: Manual das Plantas Medicinais. São Paulo-SP: Agronômica Ceres; 1992.
25. Di Stasi LC, Hiruma-Lima CA. Plantas medicinais na Amazônia e na Mata Atlântica. São Paulo-SP: Unesp; 2002.
26. Borrás MRL. Plantas da Amazônia: Medicinais ou mágica? Plantas comercializadas no mercado Adolpho Lisboa. Editora Valer/Governo do Estado do Amazonas, Manaus-AM; 2003.
27. Cavalcante R. As plantas medicinais na Odontologia: um guia prático. Expressão Gráfica, Rio Branco-AC; 2008.
28. Nakamura ES. Cancer chemopreventive effects of Caesalpinia ferrea and related compounds. Cancer Letters. 2002;(177):119-24.
29. Frasson APZ, Bittencourt CF, Heinzmann BM. Caracterização físico-química e biológica do caule de Caesalpinia ferrea Mart. Revista Brasileira de Farmacognosia. 2003;(13):35-9.
30. Gomes M. As plantas da saúde: guia de tratamentos naturais. São Paulo-SP, Paulinas. 2003;(3):351-2.
31. Braga R. Plantas do nordeste, especialmente do Ceará. Fortaleza-CE, Escola Superior de Agricultura de Mossoró; 1976. p. 540-1.
32. Coutinho HDM, Costa JGM, Lima EO, Falcão-Silva VS, Siqueira JR. Enhancement of the antibiotic activity against a multiresistant Escherichia coli by Mentha arvensis L. and chlorpromazine. Chemotherapy. 2008;54(4):328-30.
33. Matias EFF, Alves EF, Santos BS, Souza CES, Ferreira JVA, Lavor AKLS, et al. Evidence-Based Complementary and Alternative Medicine. 2013;2013(1):1-7.
34. Figueredo FG, Ferreira EO, Lucena BFF, Torres CMG, Lucetti DL, Lucetti ECP, et al. Modulation of the antibiotic activity by extracts from Amburana cearensis A. C. Smith and Anadenanthera macrocarpa (Benth.) Brenan. Biomed Res Int; 2013. p. 1-5.
35. Saúde-Guimarães DA, Faria AR. Natural compounds with anti-Trypanossoma cruzi activity. Revista Brasileira de Farmacognosia. 2007;17(3):455-65.
36. Agra IK, Pires LL, Carvalho PS, Silva-Filho EA, Smaniotto S, Barreto E. Evaluation of wound healing and antimicrobial properties of aqueous extract from Bowdichia virgilioides stembarks in mice. An Acad Bras Ciên. 2013;945-54.
37. Buttler MS, Buss AD. Natural products - the future scaffolds for novel antibiotics? Biochem Pharmacol. 2006;(71):919-29.
38. Dixon RA, Dey PM, Lamb CJ. Phytoalexins: enzymology and molecular biology. Adv Enzymol Relat Areas Mol Biol. 1983;(55):1-69.
39. Ho KY, Tsai CC, Huang JS, Chen CP, Lin TC, Lin CC, et al. Antimicrobial activity of tannin components from Vaccinium vitisidaea. J Pharm Pharmacol. 2001;(53):187-91.
40. Matias EFF, Santos KKA, Almeida TS, Costa JGM, Coutinho HDM. Enhancement of antibiotic activity by Cordia verbenacea DC. Lat Am J Pharm. 2010;(29):1049-52.
41. Sousa EO, Barreto FS, Rodrigues FFG, Costa JGM. Atividade antibacteriana e interferência de Lantana camara Linn e Lantana montevidensis Briq na resistência de aminoglicosídeos. Rev Bras de Bioci. 2011;(9):1-5.
42. Canton M, Onofre SB. Interferência de extratos da Baccharis dracunculifolia DC. Asteraceae, sobre a atividade de antibióticos usados na clínica. Revista Brasileira de Farmacognosia. 2010;(20):354-84.
43. Oliveira JFP, Cipullo JP, Burdmann EA. Nefrotoxicidade dos aminoglicosídeos. Braz J Cardiovasc Surg. 2006;(21):444-52.
44. Magnet S, Blanchad JS. Molecular insights into aminoglycoside action and resistance. Chem Rev. 2005;(105):477-97.
45. Granowitz EV, Brown RB. Antibiotic adverse reactions and drug interactions. Crit Care Clin. 2008;(24):421-42.
46. Barreiros ALBS, David JM. Estresse Oxidativo: relação entre geração de espécies reativas e a defesa do organismo, Química Nova. 2006;(29):113-23.
47. Leite NF. Atividade citoprotetora de extratos hidroalcoólicos de Psidum sobraleanum Proença Landrum e Psidium mysinites DC. Contra danos tóxicos causados pelo mercúrio. Dissertação (Mestrado em Bioprospecção Molecular). Crato-CE, Brasil: Universidade Regional do Cariri–URCA. 2014;32-3.
48. Lima LF. Avaliação do potencial antitóxico de Pityrogramma calomelanos (L.) Link. Contra o efeito do mercúrio. Dissertação (Mestrado em Bioprospecção Molecular). Crato-CE, Brasil: Universidade Regional do Cariri – URCA; 2014. p. 36-7.
Recibido: 19 de
febrero de 2015.
Aprobado:
19 de agosto de 2015.
Henrique Douglas
Melo Coutinho. Laboratório de Microbiologia e Biologia Molecular, Departamento
de Química Biológica. Universidade Regional do Cariri–URCA,
Crato-CE, Brasil.
Correo electrónico: hdmcoutinho@gmail.com