Rev Cubana Plant Med 2016;21(4)
ARTÍCULO ORIGINAL
Estudio fitoquímico y evaluación de la actividad antioxidante de Esenbeckia litoralis Donn.Sm. (Loro grande)
Phytochemical study and evaluation of the antioxidant activity of Esenbeckia litoralis Donn. Sm. (loro)
Fernis José Marin Severiche, Omar Leonardo Torres Ayazo, Gilmar Gabriel Santafe Patiño, Alex Armando Saez Vega, Camilo Antonio Guzman Teran
Universidad de Córdoba. Colombia.
RESUMEN
Introducción:
la especie Esenbeckia litoralis Donn.Sm. (Rutaceae) es también conocida
como "Loro o Loro grande", ha sido empleado en la medicina tradicional para
el tratamiento de mordeduras de serpientes, dolor de garganta y lesiones ocasionadas
por picaduras de insectos. Esta variedad de actividades son causadas por acción
de los compuestos que la constituyen, como lignanos, terpenos, alcaloides, cumarinas
y polifenoles que representan un alto potencial farmacológico para esta
especie.
Objetivo:
realizar el estudio fitoquímico y evaluación de la actividad antioxidante
de la especie E. litoralis.
Métodos:
los extractos vegetales de hojas corteza y madera se obtuvieron empleando etanol
al 96 %, y posteriormente fueron fraccionados usando técnicas cromatográficas
como Cromatografía en Capa Delgada (CCD), Cromatografía en Columna
(CC) y Cromatografía en Capa Delgada Preparativa (CCDP). Los compuestos
se identificaron mediante el análisis de datos espectroscópicos con
el empleo de técnicas instrumentales como: Infrarrojo (IR), Resonancia
Magnética Nuclear Protónica y de Carbono trece (RMN-1H
y 13C), Espectrometría de Masas (EM) y difracción de rayos
x (DRX). La actividad antioxidante se evaluó a través de los métodos
radical catiónico ABTS•+, radical libre DPPH•
y Potencial de Actividad de Reducción Férrica (FRAP).
Resultados:
de esta especie se aislaron e identificaron cinco compuestos: cuatro alcaloides
y un flavonoide. Los extractos en acetato de etilo de hojas y corteza mostraron
una significativa actividad frente a los radicales ABTS•+ con
un IC50 de 5,65 y 7,65 µg/mL respectivamente.
Conclusiones:
de los distintos extractos se aislaron cinco compuestos: 1-hidroxi-3-metoxi-N-metilacridona
(1), maculosidina (2) maculina (3), dictamina (4) y gardenina B (5). El extracto
en acetato de etilo de hojas y corteza presentaron una significativa actividad
antioxidante frente al radical ABTS con un IC50 de 5,65 y 7,65 mg/L,
respectivamente.
Palabras clave: estudio fitoquímico; actividad antioxidante; alcaloides; Esenbeckia litoralis; Rutaceae.
ABSTRACT
Introduction:
The species Esenbeckia litoralis Donn. Sm. (Rutaceae), also known as loro or
loro grande, has been used in traditional medicine to treat snakebites, sore
throats and lesions caused by insect bites. The compounds contained in the plant,
among them lignans, terpenes, alkaloids, coumarins and polyphenols, are responsible
for such a broad variety of activities, granting it great pharmacological potential.
Objective: Conduct a phytochemical study and evaluation of the antioxidant
activity of the species E. litoralis.
Methods: Plant extracts from leaves, stem and wood were obtained using
96% ethanol, and then fractioned with chromatographic techniques such as thin-layer
chromatography (TLC), column chromatography (CC) and preparative thin-layer
chromatography (PTLC). The compounds were identified by spectroscopic data analysis
using instrumental techniques such as infrared (IR) spectroscopy, proton and
Carbon-13 nuclear magnetic resonance (NMR-1H and 13C), mass spectrometry (MS)
and X-ray diffraction (XRD). Antioxidant activity was evaluated with the methods
ABTSo+ radical cation, DPPHo free radical and ferric reducing ability power
(FRAP).
Results: Five compounds were isolated from the species: four alkaloids
and one flavonoid. Ethyl acetate extracts from leaves and stem displayed significant
activity against ABTSo+ radicals, with a CI50 of 5.65 and 7.65 µg/ml,
respectively.
Conclusions: Five compounds were isolated from the various extracts:
1-hydroxy-3-methoxy-N-methylacridone (1), maculosidin (2), maculin (3), dictamin
(4) and gardenin B (5). The leaf and stem extract in ethyl acetate displayed
significant antioxidant activity against the ABTS radical, with a CI50 of 5.65
and 7.65 mg/l, respectively.
Keywords:
phytochemical study; antioxidant activity; alkaloids; Esenbeckia litoralis;
Rutaceae.
INTRODUCCIÓN
La producción excesiva de radicales libres en el organismo es responsable del estrés oxidativo,1 lo cual está asociado con la aparición de numerosas patologías como envejecimiento,2 la arterosclerosis, el cáncer, la enfermedad de Alzheimer, la diabetes mellitus, el síndrome de estrés respiratorio entre otras. Para captar la presencia de estas especies radicalarias, se debe suministrar en la dieta sustancias que contengan antioxidantes, destacándose los compuestos fenólicos tipo flavonoides.3 Algunas especies de la familia Rutaceae han sido reportadas por su acción farmacológica4 en el tratamiento de enfermedades como la malaria,5 chagas,6 leishmania7-9 y trastornos ocasionados por la acción de radicales libres.10 El extracto de corteza de Zanthoxylum fagara mostró una significativa actividad antioxidante, antiproliferativa y antiinflamatoria,11 efectos atribuidos probablemente a compuestos de tipo alcaloidal con núcleo quinolínico, furoquinolínico,12 indolopiridoquinazolínicos,13 acridónicos14 y flavonoides tipo flavonas.15
El género Esenbeckia es uno de los más representativos de la familia Rutaceae por su uso en medicina tradicional para el tratamiento de algunas enfermedades. Estudios fitoquímicos de este género demuestran la presencia de metabolitos secundarios como alcaloides, coumarinas,16 flavonoides,17-18 triterpenos,19 lignanos20-21 con una amplia actividad farmacológica. La especie E. litoralis se constituye en un excelente ejemplar para el desarrollo de este trabajo, ya que no presenta un estudio fitoquímico completo y muy poco con respecto a la actividad antioxidante.
Basado en todos estos antecedentes se planteó la posibilidad de encontrar extractos activos con potencial antioxidante frente a los radicales DPPH•, ABTS•+, así como su poder de reducción férrica,22-23 para ello se realizó el estudio fitoquímico de hojas, corteza y madera de la especie E. litoralis perteneciente a la familia Rutaceae y se evaluó la actividad antioxidante de extractos y fracciones.
MÉTODOS
Material vegetal
La muestra de la especie E. litoralis fue colectada en el año 2013 en el municipio de San Juan de Nepomuceno, departamento de Bolívar, en las siguientes coordenadas geográficas: 9º 55' 15,9'' N; 75º 05' 39.3'' W, por los profesores de la Universidad de Córdoba Omar Torres Ayazo, Fernis Marin, Heidy Saab Ramos y Rosalba Ruiz Vega quien realizó la clasificación del ejemplar y del cual reposa una muestra en el Herbario de la Universidad de Córdoba bajo el número de colección HUC-005109.
Obtención de extractos
Las hojas, corteza y madera del material vegetal seco y molido de la especie E. litoralis se sometieron a extracción por percolación con etanol al 96 % a temperatura ambiente. El solvente fue retirado a presión reducida obteniéndose así los correspondientes extractos etanólicos.
Fraccionamiento y purificación de compuestos aislados de Esenbeckia
litoralis.
Los extractos etanólicos de hojas, corteza y madera de esta especie fueron fraccionados por reparto utilizando solventes de polaridad creciente: Benzina de petróleo (BDP), Cloroformo (CHCl3), Acetato de etilo (AcOEt), n-Butanol (BuOH) y Agua (H2O).
Fraccionamiento del extracto clorofórmico de corteza
A partir de este extracto se tomaron 30,1 g y se sometieron a fraccionamiento por Cromatografía en Columna (CC) soportado en sílica gel, e iniciando el proceso de elusión con BDP: diclorometano (CH2Cl2)-1:1 y aumentando la polaridad hasta CH2Cl2:MeOH-9:1, se obtuvieron 26 fracciones (1 hasta 26) según el perfil cromatográfico mostrado. La fracción 18 (765 mg) se sometió a CC eluyendo con BDP:CH 2Cl2-1:1 y aumentando la polaridad en forma creciente,se colectaron 20 nuevas fracciones designadas A-1 hasta A-20. De la fracción A-5 se aisló un sólido color naranja denominada compuesto 1 (360 mg). La fracción A-6 (210 mg) fue sometida a CC eluyendo con CH2Cl2 puro y aumentando la polaridad hasta CH2Cl2:MeOH-95:5, obteniéndose 9 fracciones (A-6-1 hasta A-6-9). La fracción A-6-4 fue sometida a Cromatografía en Capa Delgada Preparativa (CCDP) eluyendo con CH 2Cl2:MeOH-95:5, de la cual se obtuvieron cristales amarillos, con un peso de 11.6 mg denominado compuesto 2.
La fracción A-7 (1,6 g) fue sometida a Cromatografía en Columna (133 g) eluyendo con CHCl3 y aumentando la polaridad hasta CH 2Cl2:MeOH-95:5, colectándose 91 fracciones posteriormente reunidas en 8 fracciones (A-7-1 hasta A-7-8) por análisis en CCD. Las fracciones A-7-4 y A-7-5 fueron reunidas y sometidas a Cromatografía en Capa Delgada Preparativa (CCDP) eluyendo con CH2Cl2 :MeOH- 95:5, de la cual se obtuvieron cristales amarillos (17 mg), un análisis por CCD mostró una sola mancha, denominada compuesto 3.
Fraccionamiento del extracto etanólico de madera
De este extracto, 38 g fueron sometidos a CC soportados sobre sílica gel, eluyendo con CH2Cl2 y aumentando su polaridad hasta CHCl3, las cuales fueron reunidas en 20 fracciones. Teniendo en cuenta el análisis en CCD y el peso, la fracción 6 (791 mg) se sometió a un análisis por CC con sílica gel, eluyendo con CHCl3 y aumentando la polaridad hasta CHCl 3:CH3OH-98:2 obteniéndose 93 fracciones (15 ml c/u), las cuales fueron reunidas en 6 nuevas fracciones denominadas B-1 hasta B-6 de acuerdo al estudio por CCD. La fracción B-3 (49 mg) fue sometida a CCDP eluyendo con CHCl3. De esta separación se obtuvieron 4 sustancias, de los cuales el mayoritario (30 mg) se designó compuesto 4.
Las fracciones B-8, B-9 y B-10 (566 mg) fueron reunidas y solubilizadas en CH2Cl2, generando dos fases, una porción insoluble, la cual se separó y posteriormente se solubilizó en metanol, el análisis por CCD mostró una sola mancha denominada compuesto 5.
Identificación de sustancias
Los compuestos purificados fueron identificados inicialmente con reactivos generales para metabolitos secundarios como el reactivo de Dragendorff para alcaloides y la reacción de Shinoda para flavonoides.24 La elucidación estructural de las sustancias puras se realizó con el uso de técnicas espectroscópicas IR, UV, RMN-1H, RMN- 13C, experimentos bidimensionales (COSY, HMQC, HMBC), Cromatografía de gases acoplada a espectrometría de masa - CG-EM, y por comparación con datos reportados en la literatura.
Determinación del contenido de fenoles totales
El contenido de fenoles totales se evaluó mediante el método espectrofotométrico de Folin-Ciocalteu, usando ácido gálico como material de referencia según Gutiérrez et al, 2008.25
Ensayo de actividad antioxidante
Se evaluó la actividad antioxidante de los extractos etanólicos y subextractos de la especie E. litoralis empleando el método del radical libre DPPH•, radical catiónico ABTS•+26-27 y la capacidad de reducción del Fe+3 a Fe+2 mediante el método FRAP empleado por Rojano en 2008.3 Para el análisis estadístico de los resultados de la actividad antioxidante se utilizó como herramienta el programa Minitab 16 versión 5.1 y para la determinación del IC50 por regresión lineal, se utilizó el programa Statgraphics Plus versión 5.0, con un nivel de significancia del 95 % (p< 0,05).28
RESULTADOS
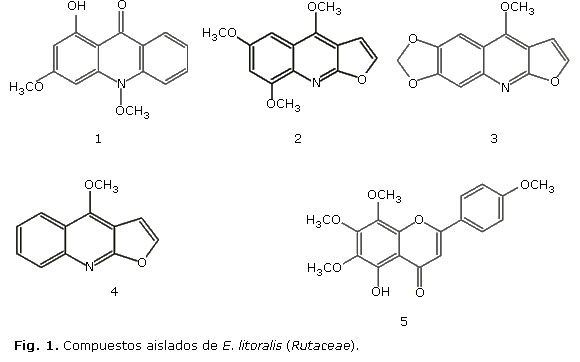
Compuestos aislados
De esta especie se purificaron cinco compuestos (fig. 1), de la corteza se aislaron tres alcaloides: un alcaloide de núcleo acridónico denominado 1-hidroxi-3-metoxi-N-metilacridona (1) y dos alcaloides quinolínicos identificados como maculosidina (2) y maculina (3); de la madera se purificaron: un alcaloide quinolínico conocido como dictamina (4) y un flavonoide tipo flavona denominado gardenina B (5). La asignación de las estructuras se realizó con base en el análisis de los datos espectroscópicos.
1-hidroxi-3-metoxi-N-metilacridona (1): Sólido anaranjado; p.f.
169-170 °C; IR: (KBr) λmax 1639, 1592 y 1556 (C= C, aromáticos)
y 1643 (C= O) cm-1; EM (IE) m/z: 255 (M+.); RMN-1H
(500 MHz, CDCl3) δ H: 3.85 (s, 3H, -OCH3);
δH: 2.70 (s, 3H, -NCH3); δH: 6.20
(d, J= 2 Hz, 1H) y δ H: 6.19 (d, J= 2 Hz, 1H) protones aromáticos
en posición meta; δH: 7.23 (t, J= 7.60 Hz, 1H); δ
H: 7.40 (d, J= 8.7 Hz, 1H); δH: 7.66 (ddd, J= 7.6,
7.8 Hz, 1H) y δH: 8.40 (dd, J= 1.6, 8.0 Hz, 1H) protones de
un anillo aromático disustituído; δH: 14.80 (s, 1H)
correspondiente a un OH fenólico. RMN-13C (125 MHz, CDCl3)
y DEPT-135: siete carbonos cuaternarios en δ C: 180.6 (C= O,
C-9), 166.0 (C-1), 165.8 (C-3), 144.2 (C-12), 142.3 (C-10), 120.9 (C-11), 105.2
(C-11') ppm; seis CH en δ C: 134.0 (C-6), 126.6 (C-8), 121.3
(C-7), 114.5 (C-5), 94.1 (C-2), 89.8 (C-4) ppm; un CH3 en δC:
55.5 (-OCH 3) y δC: 34.0 (-NCH3) ppm.
DRX: cristal monoclínico de 0.71°A, T: 295K, parámetros medidos:
coordenadas atómicas, equivalente anisotrópico, longitud de enlace,
ángulo de enlace, coordenadas de hidrógeno y parámetros de desplazamiento
isotrópico por EPPD (fig. 2).
Maculosidina (2): Sólido amarillo; IR: (KBr) λmax
3131 cm-1 (C-H, aromáticos), 2998 y 2954 cm-1 (C-H,
alifáticos), 1625 cm-1 (C-N), 1483 cm-1 (C-C), 1258
cm-1 (C-O-C) ; EM m/z 259 (M+.); RMN- 1H
(500 MHz, CDCl3); δH: 7.43 (s, 1H) y δH:
7.31 (s, 1H), protones aromáticos en anillo tetrasustituído; δH:
7.54 (d, J= 2.1 Hz, 1H) y δ H: 7.00 (d, J= 2.1 Hz, 1H) protones
característicos de un anillo furánico; δH: 4.40 (s,
3H), δH: 4.02 (s, 3H) y δH: 4.01 (s, 3H) protones
de grupos metoxilos. RMN-13C (125 MHz, CDCl3) y DEPT-135:
siete carbonos cuaternarios en δC: 163.1 (C-2), 155.4 (C-4),
152.6 (C-6), 147.7 (C-8), 142.6 (C-8a), 112.9 (C-5a) y 102.2 (C-3) ppm; cuatro
CH en δC: 142.4 (C-2'), 106.7 (C-7), 104.6 (C-3'), 100.2 (C-5)
ppm; tres CH3 en δC: 58.8, 56.0 y 55.9 ppm característicos
de metoxilos.
Maculina (3): Sólido amarillo; p.f. 200-201 °C; IR: (KBr) λmax 3125 y 3100 cm-1 (C-H aromáticos), 2925 cm-1 (C-H, alifáticos), 1619 cm-1 (C-N), 1466 cm-1 (C-C), 1368 cm-1 (C-O-C) ; EM m/z 243 (M+.); RMN-1H (500 MHz, CDCl3); δ H: 7.55 (d, J= 2.7 Hz, 1H) y δH: 7.02 (d, J= 2.7, 1H), protones de anillo furánico; protones aromáticos en anillo tetrasustituído en δH: 7.49 (s, 1H) y δ H: 7.27 (s, 1H) ppm, δH: 6.08 (s, 1H - metilendioxi) y δH: 4.40 (s, 3H - metoxilos) . RMN- 13C (125 MHz, CDCl3) y DEPT-135: siete carbonos cuaternarios en δC: 163.1 (C-2), 156.0 (C-4), 151.0 (C-6), 146.0 (C-7), 144.0 (C-8a), 114.0 (C-4a) y 101.6 (C-3) ppm; cuatro CH en δC: 142.6 (C-2'), 104.5 (C-8), 104.4 (C-3'), 98.0 (C-5) ppm; un CH2 en δC: 101.6 (-OCH2O-) ppm, un CH3 en δC: 58.9 (-OCH3).
Dictamina (4): Sólido amarillo; p.f. 130-131 °C; IR: (KBr) λmax 3108 cm-1 (C-H aromáticos), 2929, 2856 cm-1 (C-H, alifáticos), 1372 cm-1 (C-O); EMm/z 199 (M+.); RMN-1H (500 MHz, CDCl3); δH: 7.17 (ddd, J= 8.0, 1.2 Hz, 1H), δ H: 7.45 (ddd, J= 8.0, 1.3 Hz, 1H), δH: 7.77 (dd, J= 8.5 Hz, 1H) y δH: 8.02 (dd, J= 8.4, Hz, 1H) protones aromáticos, δH: 7.36 (d, J= 2.8 Hz, 1H) y δ H: 6.80 (d, J= 2.8 Hz, 1H) protones de anillo furánico, δH: 4.17 (s, 3H, -OCH3). RMN-13C (125 MHz, CDCl3) y DEPT-135: cinco carbonos cuaternarios en δ C: 164.2 (C-2), 157.1 (C-4), 146.0 (C-8a), 119.0 (C-4a) y 103.7 (C-3) ppm; seis CH en δC: 143.8 (C-2'), 129.9(C-7), 128.1 (C-8), 124.0 (C-6), 122.7 (C-5) y 105.1 (C-3') ppm y un CH3 en δC: 59.3 (-OCH3).
Gardenina B (5): Sólido; IR: (KBr) λmax 3389 cm -1 (O-H), 2929, 2928 cm-1 (C-H, alifáticos), 1715 cm-1 (C-O); RMN-1H (500 MHz, CDCl3); δH: 7.90 (d, J= 8.8 Hz, 2H) y δH: 7.04 (d, J= 8.8 Hz, 2H) característicos de un anillo aromático 1,4 disustituído, δH: 6.61 (s, 1H), δH: 12.80 (s, 1H) específico para un protón de grupo OH, δH: 4.12 (s, 3H), δH: 3.98 (s, 3H), δ H: 3.96 (s, 3H) y δH: 3.90 (s, 3H) protones de grupos metoxilos. RMN-13C (125 MHz, CDCl3) y DEPT-135: diez carbonos cuaternarios en δC: 183.0 (C-4), 164.0 (C-2), 162.0 (C-4'), 152.0 (C-7), 149.0 (C-9), 145.8 (C-5), 136.5 (C-6), 132.9 (C-8), 123.4 (C-1') y 114.6 (C-10) ppm; cinco CH en δ C: 128.0 (C-2'/C-6'), 114.6 (C-3'/C-5') y 106.0 (C-3), y cuatro grupos CH3 en δC: 62.1, δC: 61.7, δC: 61.1 y δC: 55.6, característicos de grupos metoxilos.
Contenido de fenoles totales
Para la determinación del contenido de fenoles totales de los extractos se realizó una curva de calibración usando como patrón de referencia el ácido gálico, los resultados de los diferentes valores se muestran en la fig 3 (tabla 1) y son expresados en mg de Ácido Gálico/g de Extracto.
Actividad antioxidante
La evaluación de la actividad antioxidante en los diferentes extractos mostraron una significativa capacidad captadora frente a los radicales DPPH• y ABTS+•. Los resultados de la evaluación antioxidante se muestran en la tabla 2. Todos los extractos evaluados presentaron Poder de Reducción Férrica frente al TPTZ, a partir de los datos de absorbancia obtenidos en el análisis, se realizó el diagrama de barras de Absorbancia frente a la concentración de 100 mg/L de cada extracto (fig. 4).
DISCUSION
El género Esenbeckia reviste importancia por poseer compuestos con núcleo alcaloidal, característica que también se evidenció en el estudio fitoquímico realizado sobre la especie E. litoralis, en donde se aislaron tres alcaloides quinolínicos denominados maculosidina (2), maculina (3) y dictamina (4), los cuales han sido reportados por Coy y Cuca en su estudio efectuado sobre el extracto etanólico de hojas y corteza de la especie Esenbeckia conspecta.16 De igual forma estudios realizados por Biavatti reportan el aislamiento de la maculina a partir del extracto etanólico del tallo de Esenbeckia leiocarpa.29 La elucidación estructural del alcaloide acridónico denominado 1-hidroxi-3-metoxi-N-metilacridona (1) obtenido en mayor proporción, encaja perfectamente con la descripción reportada por Lasprilla en 2007, quienes aislaron este compuesto del extracto etanólico de la corteza de E. runyonii, extracto que presentó una alta capacidad inhibitoria del crecimiento celular tumoral.30 La evaluación de la actividad antioxidante de los extractos en acetato de etilo de hojas y corteza frente al radical catiónico ABTS+•, mostró una mayor actividad antioxidante comparada con los extractos de menor polaridad como el extracto hexánico y clorofórmico, lo que indica la presencia de compuestos con capacidad captadora de radicales libres como: flavonoides, cumarinas, y alcaloides, característicos del género y de esta especie.
Se destaca la actividad presentada por los extractos en acetato de etilo de hojas y corteza ya que mostraron una gran capacidad captadora del radical radical catiónico ABTS•+ con IC50 de 7,65 µg/mL y 5,65 µg/mL respectivamente; de esta forma se puede notar que los metabolitos con mayor capacidad antioxidante están presentes en los extractos más polares como es el extracto en acetato de etilo, esto es consecuente con los metabolitos aislados, así como con los resultados mostrados por el ensayo del contenido de Fenoles Totales, donde se puede evidenciar que el extracto de acetato de etilo de hojas y corteza presentan el mayor contenido de compuestos fenólicos con valores de 87,90 mg de Ac. Gálico/g de muestra y 131,83 mg de Ac. Gálico/g de muestra. Estos valores muestran que los metabolitos que constituyen los subextractos en acetato de etilo de hojas y corteza de E. litoralis poseen una mayor afinidad para disminuir los efectos oxidantes causados por radicales iónicos como el ABTS•+ comparado con los resultados de actividad antioxidante que reporta Lasprilla en la evaluación del extracto etanólico de E. runyonii frente al radical libre DPPH, el cual no mostró capacidad antioxidante alguna.31
Este potencial antioxidante en los extractos en acetato de etilo de hojas y corteza de la especie E. litoralis, probablemente se debe a la alta concentración de compuestos fenólicos presente en estos extractos, los cuales en su mayoría poseen dentro de su estructura molecular grupos hidroxilos libres unidos al anillo aromático, que tienen la capacidad de reaccionar con el radical ABTS•+, generando un nuevo radical estabilizado por acción de la donación de electrones; produciéndose así un aumento en la capacidad antioxidante.
AGRADECIMIENTOS
Los autores agradecen a la Universidad de Córdoba por el apoyo financiero para el desarrollo de la presente investigación.
CONFLICTOS DE INTERESES
Los autores declaran que no existen conflictos de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Cardona Galeano C, Robledo Restrepo S, Alzate Guarin F, Muñoz Herrera D, Saez Vega J. Actividad leishmanicida y antioxidante de extractos de Piper daniel-gonzalezii Trel. (Piperaceae). Rev Cubana Plant Med. 2013;18(2):1-10.
2. Gaviria Montoya C, Gil Garzón M, Saez Vega J, Schinella GR, Tournier G, Rojano BA. Actividad antioxidante del isoespintanol en diferentes medios. Rev Vitae. 2008;15(1):173-81.
3. Mayor-Oxilia R. Estrés Oxidativo y Sistema de Defensa Antioxidante. Rev Inst Med Trop. 2010;5(2):23-9.
4. Coy Barreras C, Cuca Suarez L, Quintero Londoño C. Farmacognosia y Farmacobotánica de Especies Pertenecientes a los Géneros Esenbeckia y Raputia (Rutaceae). Rev Cubana Plant Med. 2013;18(4):638-53.
5. Lozano Moreno J, Cuca Suarez L. Propiedades antimicrobianas in vitro de metabolitos secundarios aislados de Peltostigma guatemalense, una especie colombiana de Rutaceas contra el parásito Plasmodium falciparum y contra cepas bacterianas. Rev Colomb Cienc Quím Farm. 2008:37(2):164-76.
6. Pepe-Ambrozin A, Fernandes da Silva M, Vieira PC, Fernandes JB, Albuquerque S. Trypanocidal activity of Meliaceae and Rutaceae plant extracts. Mem Inst Oswaldo Cruz. 2004:99(2): 227-31.
7. Granados Fallas D.S. Determinación de la actividad leishmanicida e inmunomoduladora de compuestos naturales derivados de Raputia heptaphylla (familia Rutaceae) como posible alternativa terapéutica frente a la leishmaniosis cutánea. Tesis Doctoral. Universidad Nacional de Colombia; 2013.
8. Arango Valencia V, Robledo Restrepo S, Seón-Méniel B, Figadére B, Cardona Galeano W, Sáez Vega J, et al. Coumarins from Galipea panamensis and Their Activity against Leishmania panamensis. J Nat Prod. 2010;73:1012-4.
9. Gimenez Turba A. Estudios químicos, biológicos y farmacológicos de Galipea longiflora, Krause. Rev Bol Quím. 2005;22(1):94-107.
10. Ojito Ramos K, Herrera Sánchez Y, Vega Pérez N, Portal Villafaña O. Actividad antioxidante in vitro y toxicidad de extractos hidroalcohólicos de hojas de Citrus spp. (Rutaceae). Rev Cubana Plant Med. 2012;17(4):368-79.
11. Macías Villamizar V, Coy Barreras E, Cuca Suarez L. Análisis fitoquímico preliminar y actividad antioxidante, antiinflamatoria y antiproliferativa del extracto etanólico de corteza de Zanthoxylum fagara (L.) Sarg. (Rutaceae). Rev Cubana Plant Med. 2011;16(1):43-53.
12. Joseph PM. Quinoline, quinazoline and acridone alkaloids. Nat Prod Rep. 2007;24:223-46.
13. Januario AH, Vieira PC, Fernandes da Silva MF, Fernandes JB, De Brito Silva J, Conserva LM. Alcaloides indolopiridoquinazolínicos de Esenbeckia grandiflora Mart. (Rutaceae). Quim Nova. 2009;32(8):2034-8.
14. Ngoumfo RM. In vitro cytotoxic activity of isolated acridones alkaloids from Zanthoxylum leprieurii Guill. et Perr. Bioorg Med Chem. 2010;18(10):3601-5.
15. Barros-Filho B. Metabólitos secundários de Esenbeckia almawillia kaastra (Rutaceae). Quim Nova. 2007;30(7):1589-91.
16. Coy Barrera C, Cuca Suarez L. Metabolitos secundarios aislados de los géneros Raputia y Esenbeckia (Rutaceae). Scientia et Technica. 2007;13(33): 37-8.
17. Aslam M, Intekhab J. Isolation of a flavonoid from Feronia limonia. Journal of Saudi Chemical Society. 2009;13(3):295-8.
18. Intekhab J, Aslam M. Isolation of a flavone glucoside from Glycosmis mauritiana (Rutaceae). Arabian J Chem. 2011;4(1):79-81.
19. Rios Gomez M, Aguilar-Guadarrama A, Delgado Lamas G. Furoquinoline alkaloids, furocoumarins and terpenes from Esenbeckia litoralis (Rutaceae). Biochem Syst Ecology. 2002;30(1):977-9.
20. De Liz R, Pereira DF, Dalmarco EM, Dalmarco JB, Simionatto EL, Pizzolatti MG, et al. Protected effect of Esenbeckia leiocarpa upon the inflammatory response induced by carrageenan in a murine air pouch model. Int Immunopharmacol. 2011;11(12):1991-9.
21. Cuca Suarez L, Coy Barreras E, Alvarez Caballero J. Quinoline alkaloids and friedelane-type triterpenes isolated from leaves and wood of Esenbeckia alata Kunt (Rutaceae). Quim Nova. 2011;34(6):984-6.
22. Ou B, Huang D, Hampsch-Woodill M, Flanagan JA, Deemer EK. Analysis of Antioxidant Activities of Common Vegetables Employing Oxygen Radical Absorbance Capacity (ORAC) and Ferric reducing Antioxidant Power (FRAP) Assays: A Comparative Study. J Agric Food Chem. 2002;50:3122-8.
23. Restrepo Duque A, Cortés Rodríguez M, Rojano BA. Potenciación de la Capacidad Antioxidante de Fresa (Fragaria ananassa Duch.) por Incorporación de Vitamina E Utilizando la Técnica de Impregnación a Vacío. Rev Vitae. 2010;17(2):135-40.
24. Beltran Villanueva C, Díaz Castillo F, Gomez Estrada H. Tamizaje fitoquímico preliminar de especies de plantas promisorias de la costa atlántica colombiana. Rev Cubana Plant Med. 2013;18(4);619-31.
25. Gutiérrez Avella D, Ortiz García C, Mendoza Cisneros A. Medición de Fenoles y Actividad Antioxidante en Malezas Usadas para Alimentación Animal. Simposio de Metrología. 22-24 Octubre, Santiago de Querétaro, México; 2008.
26. Montaño Castañeda M, Santafé Patiño G. Evaluation of antioxidant activity of marine sponges from the Colombian Caribbean. Actu Bio. 2011;33(95):173-5.
27. Guzman Navas M, Santafé Patiño G, Salcedo Lozano M, Angulo Ortíz A, Torres Ayazo O. Estudio químico y actividades antioxidante y bactericida de Ganoderma applanatum. Rev Bio Agro. 2013;11(1):88-94.
28. Cuadrado Soto I. Estudio fitoquímico de la madera de Zanthoxylum setulosum (Rutaceae) y evaluación de la actividad antioxidante. Tesis de Química. Universidad de Córdoba; 2011.
29. Biavatti MW. Biological Activity of Quinoline Alkaloids from Raulinoa echinata and X-ray Structure of Flindersiamine. J Braz Chem Soc. 2002;13(1):66-70.
30. Lasprilla Coll J, Cuca Suárez L. Estudio Fitoquímico del extracto etanólico de la corteza de Esenbeckia runyonii (Rutaceae). Scientia et Technica. 2007;33(7):373-6.
Recibido: 30 de
abril de 2015.
Aceptado: 21 de
octubre de 2016.
Omar Leonardo Torres Ayazo. Universidad de Córdoba, Colombia. Correo electrónico: omart2365@gmail.com