Uso medicinal de plantas antidiabéticas en el legado etnobotánico oaxaqueño
Medicinal use of antidiabetic plants in Oaxacan ethnobotanical tradition
Lic. Carlos Jonnathan Castro Juárez, Dr. C. Nemesio Villa Ruano, Dr. C. Sergio Alberto Ramírez García, Dr. C. Clemente Mosso González
Universidad de la Sierra Sur. Oaxaca, México.
Introducción: la diabetes mellitus
tipo 2 es uno de los principales padecimientos crónicos degenerativos
en México. Diversos tratamientos se usan para atender a la población
oaxaqueña de este país, incluido el empleo de plantas medicinales.
Objetivo: efectuar una revisión bibliográfica exhaustiva a
través de plataformas electrónicas científicas, con el
objetivo de hallar datos sobre plantas antidiabéticas y sus extractos
con efecto hipoglucemiante, que son usadas empíricamente en Oaxaca, México.
Métodos: se realizó una búsqueda bibliográfica
exhaustiva de estudios científicos concernientes a la evaluación
de la actividad biológica (que incluyen pruebas in vitro e in
vivo) y la química de plantas comúnmente utilizadas para el
tratamiento de la diabetes en el estado de Oaxaca, México.
Resultados: se presentan 35 plantas de 22 familias botánicas que
se usan para el tratamiento de la diabetes mellitus tipo 2, entre ellas se cuenta
con un número mayor de especies de las familias Lamiaceae, Cecropiaceae
y Equisetaceae. De las 35 especies, 23 sustentan su acción antidiabética
en modelos animales y solo en 19 se lograron identificar los compuestos con
actividad hipoglucemiante.
Conclusión: aproximadamente 77 % de estas plantas cuenta con estudios
sobre el efecto de sus extractos o bien acerca de sus metabolitos secundarios
individuales. Algunas plantas usadas empíricamente en el estado de Oaxaca,
México, contienen flavonoides y terpenos bien identificados con actividad
antioxidante e inhibitoria de enzimas del metabolismo de carbohidratos. Miembros
específicos de estas familias de metabolitos poseen efecto evidente en
la regulación de la glucemia bajo previos bioensayos in vivo o
in vitro. Estos hallazgos sustentan de modo coherente el uso milenario
de las especies aquí tratadas.
Palabras clave: plantas medicinales, etnobotánica, Oaxaca, diabetes mellitus.
Introduction: type 2 diabetes mellitus
(DM2) is one of the most common chronic degenerative diseases in Mexico. Medicinal
plants are one of the treatments provided to the Oaxacan population suffering
from this disease.
Objective: carry out an exhaustive bibliographic review in electronic scientific
databases with the purpose of collecting information about antidiabetic plants
and hypoglycemic extracts empirically used in Oaxaca, Mexico.
Methods: an exhaustive bibliographic search was conducted for scientific
studies dealing with the biological activity (in vitro and in vivo
tests) and chemical characteristics of plants commonly used to treat diabetes
in the state of Oaxaca, Mexico.
Results: a presentation is made of 35 plants from 22 botanical families
which are used to treat type 2 diabetes mellitus. Most of these species are
from the families Lamiaceae, Cecropiaceae and Equisetaceae. In 23 of the 35
species, antidiabetic action was tested in animal models, and only in 19 of
them could compounds with hypoglycemic activity be identified.
Conclusion: about 77 % of these plants have reports on the effect of their
extracts or their individual secondary metabolites. Some of the plants used
empirically in the state of Oaxaca, Mexico, contain clearly identified flavonoids
and terpenes with antioxidant activity and inhibitory action on enzymes involved
in carbohydrate metabolism. Previous in vitro and in vivo assays
have shown that certain members of these metabolite families have an obvious
effect on glycemia regulation. These findings consistently support the millenarian
use of the species herein dealt with.
Key words: medicinal plants, ethnobotany, Oaxaca, diabetes mellitus.
INTRODUCCIÓN
Actualmente, la diabetes mellitus tipo 2 (DM2) se ha convertido en una prioridad en el sector salud de México.1 Se trata de una enfermedad compleja con una heterogeneidad de mecanismos patogénicos, entre ellos la insuficiencia en la producción de insulina por parte de las células beta (ß) del páncreas, la cual es uno de los principales blancos tratados con fármacos para el control metabólico y desarrollo de complicaciones crónicas.2-3 El tratamiento de la DM2 es apoyado por medio de la medicina tradicional y específicamente a través de la fitoterapia empírica, que poco a poco ha tomado bases científicas más sólidas.4 Esta última opción puede ser de beneficio considerable, especialmente durante las primeras etapas de la enfermedad, porque existe evidencia acerca de la eficacia en el empleo de fitomedicamentos o suplementos alimenticios sobre la base de vegetales, con menos efectos secundarios, que son usados como parte de la medicina alternativa. En Alemania está el caso del Hando®, sobre la base de nopal (Opuntia sp.), fabricado por Hando Austria y el Sucontral® (Coplachi: Hintonia sp.) fabricado por Harras Pharma, Munich.5
En México, el uso y conocimiento de plantas medicinales se desarrolló en las culturas prehispánicas y se acentúa esta práctica por 3 razones: la atención a sus enfermedades, la extensa flora, así como una amplitud en número de grupos indígenas que conservan sus propias tradiciones.6 Debido a esto, el país presenta las condiciones óptimas para la identificación de plantas que podrían fungir como base para el desarrollo de fitofármacos para el tratamiento de la DM2. Así bien, uno de los estados con más recursos etnobotánicos producto de un gran legado multicultural es Oaxaca. Sin embargo, no existe algún compilado concreto sobre el uso de plantas medicinales de este estado para el tratamiento de la DM2, basado en soporte científico que demuestre o explique de algún modo su efectividad. Por causa de lo anterior, el objetivo de este documento se enfoca en recopilar información de una gran parte de plantas con uso empírico en el estado para el tratamiento de la DM2, pero también esta actividad es contrastada con la química intrínseca y su evaluación en modelos animales con el propósito de mostrar datos concisos que sostengan su empleo medicinal.
MÉTODOS
Se realizó una búsqueda exhaustiva de referencias concernientes a la evaluación de la actividad biológica y la química de plantas, comúnmente utilizadas en el tratamiento de la diabetes en el estado de Oaxaca, México, en los principales portales científicos: PubMed, Science Direct, Springer-Link, Wiley, Redalyc, Latin Index, entre otros índices disponibles en las bases de datos cibernéticas. Toda la literatura analizada se encuentra en el intervalo desde 1985 hasta 2012. Los nombres científicos se consultaron en el International Plant Names Index (IPNI). Cabe mencionar, que en algunos casos se recopilaron datos sobre el uso empírico de algunas plantas a partir de estudios de tesis en universidades del estado de Oaxaca.
RESULTADOS
En la tabla 1 son mostradas 35 especies certificadas de plantas comúnmente usadas para el tratamiento de la DM2 en el estado de Oaxaca, también los nombres comunes asignados de acuerdo a la región, partes de la planta y la forma en la cual se obtienen los preparados fitoterapéuticos. La distribución de esta información se analiza por familias botánicas.
Tabla 1. Plantas con efecto antidiabético usadas en el estado de Oaxaca, México
|
Familia botánica |
Nombre científico |
Nombre popular en Oaxaca |
Parte utilizada |
Forma de preparación |
No. citación |
|
Agavaceae |
Agave |
Maguey |
Hojas, tallo |
Hervida |
52 |
|
Apocynaceae |
Plumeria |
Cacaloxochitl (Ahaipuih en mije) |
Flores |
Desconocido |
53 |
|
Asteraceae |
Calea |
Caunashana |
Hojas, tallo |
Mezclado con oreja de ratón* |
52 |
|
Asteraceae |
Parthenium hysterophorus L. |
Altamisa (ujts en mixe) |
Ramas |
Desconocido |
53 |
|
Bignoniaceae |
Tecoma stans (L.) Kunth. |
Trovador |
Hojas |
Cocida |
54 |
|
Bombacaceae |
Pachira aquatica Aubl. |
Apompo |
Raíces |
Infusión |
4 |
|
Burseraceae |
Bursera simaruba (L.) Sarg. |
Palo mulato |
Corteza |
Decocción |
4 |
|
Cactaceae |
Ferocactus latispinus
|
Biznaga |
Toda |
Hervida en té |
52 |
|
Cactaceae |
Opuntia streptacantha Lem. |
Nopal (nangachas-nüic en huave) |
Penca |
Extracto |
53 |
|
Brassicaceae |
Lepidium virginicum L. |
Semilla de lenteja |
Ramas |
Infusión (agua de tiempo) |
55, 56, 57 |
|
Equisetaceae |
Equisetum hyemale L. |
Cola de caballo, carricillo y cañuela |
Desconocido |
Desconocido |
5, 57, 58 |
|
Equisetaceae |
Equisetum laevigatum A. Braun |
Cola de caballo, carricillo y cañuela |
Desconocido |
Desconocido |
5, 57, 58 |
|
Equisetaceae |
Hippochaete myriochaeta Schltdl. Cham. |
Cola de caballo, carricillo y cañuela |
Desconocido |
Desconocido |
5, 57, 58 |
|
Euphorbiaceae |
Cnidoscolus chayamansa Mc Vaugh |
Chaya |
Hojas |
Infusión (agua de tiempo) |
59 |
|
Lamiaceae |
Hyptis suaveolens (L.) Poit. |
Salvia |
Hojas, tallo |
Infusión |
4 |
|
Lamiaceae |
Salvia |
Bretonica |
Hojas |
Cocida, fresca |
54 |
|
Lamiaceae |
Salvia amarissima Ort. |
Bretonica |
Hojas |
Cocida |
54 |
|
Lamiaceae |
Marrubium vulgare L. |
Marrubio |
Ramas |
Cocida |
54 |
|
Lamiaceae |
Salvia |
Bretonica |
Hojas |
Infusión |
52 |
|
Lamiaceae |
Salvia L. |
Salvia de castilla |
Ramas, hojas |
En té |
52 |
|
Leguminosae |
Sweetia panamensis Benth. |
Huayacán, Guayacan, bálsamo ama-Carrillo |
Corteza |
Decocción |
4 |
|
Leguminosae |
Acacia |
Huizache (Bihi en zapoteco) |
Ramas |
Desconocido |
53 |
|
Aloaceae |
Aloe vera L. |
Sábila |
Hoja |
Decocción |
55, 56, 57 |
|
Cecropiaceae |
Cecropia obtusifolia Bertol. |
Guarumbo, Chancarro, hormiguillo, Chiflón y Koochlé. |
Hojas secas |
Infusión |
38 |
|
Cecropiaceae |
Cecropia |
Huarumbo, Quina y Guarumbo |
Hojas, raíz, tallo |
Infusión |
4 |
|
Cecropiaceae |
Cecropia sp. |
Guarombo, guarumbo. |
Hojas, ramas |
Infusión |
4 |
|
Musaceae |
Musa |
Flor de plátano |
Raíz, flores |
Infusión, decocción |
4 |
|
Musaceae |
Musa |
Flor de plátano |
Raíz, flores |
Infusión, decocción |
4 |
|
Nyctaginaceae |
Salpianthus macrodonthus Stand. |
Catarinita, catarinilla |
Hojas, flores, raíz |
Decocción |
4 |
|
Phytolaccaceae |
Phytolacca L. |
Sangre de toro o perla china |
Fruto |
Desconocido |
52 |
|
Rhamnaceae |
Colubrina elliptica (Sw.) Briz. & WL Stern |
Palo de amole |
Corteza |
Infusión, decocción |
45 |
|
Rhizophoraceae |
Rhizophora mangle L. |
Mangle Rojo (mangle dulce) |
Corteza |
Desconocido |
53 |
|
Rosaceae |
Eriobotrya japonica (Thunb.) Lindl. |
Níspero |
Hojas, Flores |
La infusión, decocción |
4 |
|
Rubiaceae |
Hamelia |
Coral |
Flor |
Infusión (agua de tiempo) |
55, 56, 57 |
|
Verbenaceae |
Lantana camara L. |
Orozuz (toots-kumod en mixe) |
Hojas, ramas |
Desconocido |
53 |
* Dichondra argentea Wild. (Convolvulaceae)
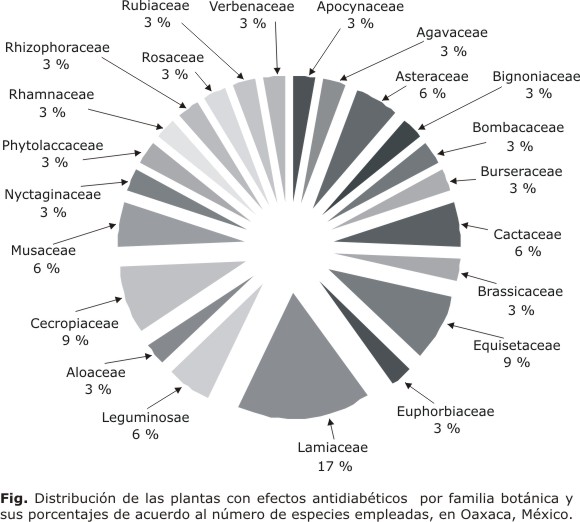
Las 35 plantas son incluidas heterogéneamente en 22 familias, siendo mayormente utilizadas las plantas de la familia Laminaceae con 17 %, seguidas de las familias Cecropiaceae y Equisetaceae, cada una con 9 %. Por otra parte, las familias Asteraceae, Cactaceae, Musaceae y Leguminaceae presentan solo 6 % del total de plantas (Fig.).
De entre estas plantas solo 19 contienen productos naturales que justifican un efecto hipoglucemiante (tabla 2).
Tabla
2. Estudios científicos
realizados en algunas plantas con efecto antidiabético que sustentan
sus propiedades hipoglucemiantes, en Oaxaca, México
|
Nombre científico |
Compuesto activo |
Pruebas en animales |
Nombre científico |
Compuesto activo |
Pruebas en animales |
|
Agave potatorum Zucc. |
ND |
ND |
Lepidium virginicum L. |
ND |
* |
|
Acacia farnesiana (L.) Willd. |
ND |
* |
Marrubium Vulgare L. |
* |
* |
|
Aloe vera L. |
* |
* |
Musa sapientum L. |
* |
* |
|
Bursera simaruba (L.) Sarg. |
ND |
ND |
Musa paradisiaca L. |
* |
* |
|
Calea ternifolia Kunth. |
ND |
ND |
Opuntia streptacantha Lem. |
* |
* |
|
Cecropia obtusifolia Bertol |
* |
* |
Parthenium hysterophorus L. |
ND |
* |
|
Cecropia sp. |
* |
* |
Pachira aquatica Aubl. |
ND |
ND |
|
Cnidoscolus chayamansa Mc Vaugh |
* |
* |
Plumeria rubra L. |
* |
* |
|
Colubrina elliptica (Sw.) Briz. & WL Stern |
ND |
* |
Phytolacca L. |
ND |
ND |
|
Crecopia peltata T. |
* |
ND |
Rhizophora mangle L. |
* |
* |
|
Equisetum hyemale L. |
* |
* |
Salvia Amarissima Ort. |
ND |
ND |
|
Equisetum laevigatum Braun |
** |
ND |
Salvia splendens Ker Gawl. |
ND |
* |
|
Hippochaete myriochaeta Schltr., Cham. |
** |
ND |
Salvia L. |
* |
* |
|
Eriobotrya japonica (Thunb.) Lindl. |
* |
* |
Salvia urica Epling |
ND |
ND |
|
Ferocactus latispinus Britton & Rose |
ND |
* |
Salpianthus macrodonthus Stand. |
* |
* |
|
Hamelia patens Jacq. |
ND |
ND |
Sweetia panamensis Benth. |
* |
* |
|
Hyptis suaveolens (L.) Poit. |
* |
* |
Tecoma stans (L.) Kunth. |
* |
* |
|
Lantana camara L. |
* |
* |
*: denota la identificación
del compuesto bioactivo putativo o la comprobación del efecto hipoglucemiante
de la planta
mediante estudios con modelos biológicos. ND: plantas sin estudios farmacológicos
no determinados a la fecha.
**: el kaempferol es un marcador quimiotaxonómico común de una parte de la familia
de los equisetos que podría contenerse
en Equisetum laevigatum
y
Hippochaete myriochaeta.
A continuación se describen los hallazgos que demuestran el sustento científico de las plantas utilizadas para el tratamiento de la diabetes en este estado mexicano.
Familia Apocynaceae
Plumeria rubra L.
P. rubra contiene glucósidos de flavona 4'-O-metil-kaemperol y quercetina.7 Un modelo en ratas diabéticas demostró que P. rubra reduce significativamente los niveles de triglicéridos, urea, creatinina, así como las actividades de las enzimas alanino aminotransferasa y aspartato transaminasa. De igual manera se observó una reducción del estrés metabólico, que se vio reflejado en la inhibición de la producción de malondialdehído en 62 % a dosis de 50 g y 73 % a dosis de 100 g.8 Los resultados sugieren que el efecto hipoglucemiante podría estar relacionado con la capacidad antioxidante de los glucósidos de flavona, compuestos que la familia Apocynaceae contiene en cantidad elevada, a los cuales también se les atribuyen propiedades anticancerosas y antimicrobianas.7
Familia Asteraceae
Parthenium hysterophorus L.
En un estudio llevado a cabo en ratas tipo Wistar normales y diabéticas inducidas por aloxano se utilizó el extracto acuoso de P. hysterophorus; este demostró tener propiedades hipoglucemiantes en el último grupo, sin embargo, el principio activo no ha sido plenamente identificado. El extracto acuoso de P. hysterophorus no parece estimular a las células ß para la producción de insulina, por lo que se postula que el preparado podría actuar a un nivel distinto, aún no clarificado.9
Familia Bignoniaceae
Tecoma stans (L.) Kunth.
T. stans es ampliamente utilizada para
el tratamiento empírico de la DM2 en Oaxaca y el resto de México.10
Se ha demostrado que las hojas contienen alcaloides (boschniakina, 4-noractinidina,
tecomina, tecomanina, tecostatina, tecostidina, N-normetilskitantina y![]() -skitatina),
triterpenoides (ácido ursólico, oleanólico,
-skitatina),
triterpenoides (ácido ursólico, oleanólico,![]() -amirina
y ß-sitosterol), compuestos fenólicos (ácidos clorogénico,
vanilico, o-cumaríco y sinápico). 11 En un estudio
realizado por Alonso-Castro y otros se evaluó el efecto de los
extractos acuosos de T. stans (TSE) en la captación de glucosa,
por adipocitos humanos y en el sistema murino T3-F442A.10 Se valoró
la estimulación de la producción de insulina mediante la captación
de 2 - [N-(7-nitrobenz-2-oxa-1 ,3-diazol-4-il amino] -2 - desoxi-D-glucosa (2-NBDG),
un análogo de glucosa con capacidad fluorescente, que es usado para fines
de rastreo metabólico. Esos resultados demuestran que a 70 g/mL de TSE,
fue promovido el transporte de glucosa en adipocitos murinos en 193 % y en humanos
115 %. En adipocitos resistentes a la insulina, el TSE indujo la captación
de 2-NBDG en 94 % (murinos) y 70 % (humanos), en comparación con los
adipocitos sensibles a los que se les proporcionó insulina.10 Estudios
realizados por Lozoya-Meckes y Mellado-Campos muestran
que el TSE posee una capacidad hipoglucemiante en perros, los efectos observados
sobre los parámetros sanguíneos parecen estar relacionados con
el metabolismo de glicógeno hepático, que implica la activación
de la glucogenólisis.12 Uno de los probables compuestos candidato
con efecto hipoglucemiante en la planta podría ser el ácido ursólico,
debido a que existen reportes científicos acerca de su efecto en la reducción
de los niveles de glucosa en sangre.13 Adicionalmente, se ha demostrado
que el extracto acuoso de T. stans presenta una actividad inhibidora
de la
-amirina
y ß-sitosterol), compuestos fenólicos (ácidos clorogénico,
vanilico, o-cumaríco y sinápico). 11 En un estudio
realizado por Alonso-Castro y otros se evaluó el efecto de los
extractos acuosos de T. stans (TSE) en la captación de glucosa,
por adipocitos humanos y en el sistema murino T3-F442A.10 Se valoró
la estimulación de la producción de insulina mediante la captación
de 2 - [N-(7-nitrobenz-2-oxa-1 ,3-diazol-4-il amino] -2 - desoxi-D-glucosa (2-NBDG),
un análogo de glucosa con capacidad fluorescente, que es usado para fines
de rastreo metabólico. Esos resultados demuestran que a 70 g/mL de TSE,
fue promovido el transporte de glucosa en adipocitos murinos en 193 % y en humanos
115 %. En adipocitos resistentes a la insulina, el TSE indujo la captación
de 2-NBDG en 94 % (murinos) y 70 % (humanos), en comparación con los
adipocitos sensibles a los que se les proporcionó insulina.10 Estudios
realizados por Lozoya-Meckes y Mellado-Campos muestran
que el TSE posee una capacidad hipoglucemiante en perros, los efectos observados
sobre los parámetros sanguíneos parecen estar relacionados con
el metabolismo de glicógeno hepático, que implica la activación
de la glucogenólisis.12 Uno de los probables compuestos candidato
con efecto hipoglucemiante en la planta podría ser el ácido ursólico,
debido a que existen reportes científicos acerca de su efecto en la reducción
de los niveles de glucosa en sangre.13 Adicionalmente, se ha demostrado
que el extracto acuoso de T. stans presenta una actividad inhibidora
de la![]() -glucosidasa y también
revierte la resistencia a la insulina en los adipocitos en un proceso mediado
por el factor de necrosis tumoral (TNF).10,14 Es importante mencionar
que los extractos acuosos de la planta poseen cierto grado de toxicidad, por
lo que es altamente recomendable estandarizar las dosis para su empleo medicinal.15
-glucosidasa y también
revierte la resistencia a la insulina en los adipocitos en un proceso mediado
por el factor de necrosis tumoral (TNF).10,14 Es importante mencionar
que los extractos acuosos de la planta poseen cierto grado de toxicidad, por
lo que es altamente recomendable estandarizar las dosis para su empleo medicinal.15
Familia Cactaceae
Ferocactus latispinus Britton & Rose.
Los efectos hipoglucemiantes de extractos obtenidos con hexano, cloroformo y metanol a partir de frutos de F. latispinus se evaluaron por la administración oral en un modelo de ratas normales y con diabetes inducida por estreptozotocina (STZ). Los extractos clorofórmicos fueron los más efectivos incrementando los niveles de superóxido dismutasa (SOD), glutatión reductasa, catalasa y glutatión peroxidasa (GSH-Px), el contenido de glucógeno hepático, la glucosa-6-fosfatasa y los niveles de insulina plasmática. También producen disminución de la glucocinasa (GK) y productos de la peroxidación de los lípidos (sustancias reactivas al ácido tiobarbitúrico "TBARS"). 16
Opuntia streptacantha Lem.
O. streptacantha, comúnmente conocida como nopal, es una planta con gran tradición en el tratamiento de la diabetes en todo México, incluida Oaxaca. El mecanismo hipoglucemiante de O. streptacantha se evaluó en ratas diabéticas por STZ con 2 extractos acuosos diferentes, el primer extracto fue preparado a partir de la filtración del licuado tradicional de cladodio (LE) y el segundo (FE) consistió en una segunda filtración del primero. Ambos extractos contenían niveles elevados de ácido (4-hidroxi)-fenil acético, un compuesto aromático hidrosoluble recién identificado. El par de extractos se administró a dosis estandarizadas (LE 135 mg/kg y FE 27 mg/kg), pero de modo sorprendente no se observó un efecto hipoglucemiante significativo. En un segundo intento por explicar el efecto hipoglucemiante del nopal, los extractos se administraron antes de una prueba de tolerancia a la glucosa oral (OGTT) utilizando las mismas dosis, pero en esta ocasión el nivel de glucosa disminuyó drásticamente en el mismo modelo animal. Con estas pruebas se deduce que los extractos LE y FE de O. streptacantha producen un efecto antihiperglucémico siempre y cuando sean administrados antes de una demanda de glucosa, y este efecto se mantiene después de filtrar el extracto. Por lo tanto, se genera el supuesto de que el nopal reduce la glucemia mediante el bloqueo de la biosíntesis de glucosa hepática y es especialmente efectivo en el estado de ayuno.1
Para explicar el modo de acción hipoglucemiante
de los extractos acuosos del nopal existen distintas hipótesis, dentro
de estas, la más defendida es el bloqueo de la hidrólisis de disacáridos
por inhibición enzimática de la![]() -glucosidasa
(AGIS). En un ensayo realizado por Becerra-Jiménez y Andrade-Cetto
y otros, para probar esta hipótesis, se utilizaron 6 extractos diferentes,
usando a la
-glucosidasa
(AGIS). En un ensayo realizado por Becerra-Jiménez y Andrade-Cetto
y otros, para probar esta hipótesis, se utilizaron 6 extractos diferentes,
usando a la![]() -glucosidasa en condiciones
in vitro, 4 de los cuales eran extractos acuosos que varían de
acuerdo con el procedimiento de eliminación de las partículas
insolubles.2 También se probó el ácido (4-hidroxi)-fenil
acético por separado. Como resultado de estos experimentos no se observó
inhibición enzimática de la
-glucosidasa en condiciones
in vitro, 4 de los cuales eran extractos acuosos que varían de
acuerdo con el procedimiento de eliminación de las partículas
insolubles.2 También se probó el ácido (4-hidroxi)-fenil
acético por separado. Como resultado de estos experimentos no se observó
inhibición enzimática de la![]() -glucosidasa.
Sin embargo, descartada la hipótesis sobre el mecanismo de acción
del nopal, se propone verificar un posible efecto insulinogénico.2
-glucosidasa.
Sin embargo, descartada la hipótesis sobre el mecanismo de acción
del nopal, se propone verificar un posible efecto insulinogénico.2
Familia Brassicaceae y familia Leguminosae
Lepidium virginicum L. y Acacia farnesiana (L.) Willd.
Un estudio reciente mostró el efecto inhibidor
de la![]() -glucosidasa y la lipasa
pancreática por parte de los extractos hidroalcohólicos de A.
farnesiana y L. virginicum. La acarbosa y el orlistat se utilizaron como
estándares positivos de inhibición. A. farnesiana mostró
una inhibición de la
-glucosidasa y la lipasa
pancreática por parte de los extractos hidroalcohólicos de A.
farnesiana y L. virginicum. La acarbosa y el orlistat se utilizaron como
estándares positivos de inhibición. A. farnesiana mostró
una inhibición de la![]() -glucosidasa
de 21,0 % ± 3,01, L. virginicum 18,0 % ± 1,1, por otra parte,
la inhibición de lipasa fue de 26 % y 9,6 %, respectivamente. A pesar
de que estos resultados muestran un efecto no significativo por parte de A.
farnesiana y L. virginicum, se manifiesta la existencia de componentes
diluidos en esos extractos que participan en la modulación del metabolismo
de carbohidratos y lípidos.17 Futuros ensayos cromatográficos
y espectrométricos son requeridos para identificar y aislar los compuestos
bioactivos individuales, que en esta forma podrían ser más efectivos.
-glucosidasa
de 21,0 % ± 3,01, L. virginicum 18,0 % ± 1,1, por otra parte,
la inhibición de lipasa fue de 26 % y 9,6 %, respectivamente. A pesar
de que estos resultados muestran un efecto no significativo por parte de A.
farnesiana y L. virginicum, se manifiesta la existencia de componentes
diluidos en esos extractos que participan en la modulación del metabolismo
de carbohidratos y lípidos.17 Futuros ensayos cromatográficos
y espectrométricos son requeridos para identificar y aislar los compuestos
bioactivos individuales, que en esta forma podrían ser más efectivos.
Sweetia panamensis Benth
Andrade-Cetto y Wiedenfel y otros realizaron una revisión de estudios fitoquímicos de S. panamensis, una planta con efecto antidiabético, en donde se identificaron varios alcaloides quinolizidínicos como acosmina, acosminina, hidroxiesparteína, así como lupanina.18 Adicionalmente se encontró ácido cafeico y 3 pironas denominadas desmetlilangonina, ß-D-O-glucósido, y ß-D-O-di (1-6) glucósido; estos 2 últimos son compuestos nuevos. Posteriormente, estos autores comprobaron el efecto hipoglucémico de los extractos acuosos de S. panamensis en ratas diabéticas inducidas por STZ. Se usaron extractos acuosos y butanólicos a diferentes dosis utilizando como grupo control glibenclamida (3 mg/kg), además de probar el efecto de las pironas nuevas. Los extractos acuosos a dosis de 20 y 200 mg/kg mostraron actividad hipoglucemiante en 180 min. El extracto butanólico a dosis de 20 y 100 mg/kg también disminuyó el nivel de glucosa en plasma, la actividad máxima se observó después de 180 min comparable al extracto acuoso. Un efecto similar se notó con la mezcla de pironas aisladas, lo cual sugiere fuertemente su participación en el la actividad hipoglucemiante generada por los extractos polares aquí descritos.18
Familia Equisetaceae
Hippochaete myriochaeta Schltdl. Cham.
Los compuestos aislados de H. myriochaeta fueron pinocembrina, crisina, ß-sitosterol, ß-D-glucosil sitosterol, ß-D-glucosa y ácidos grasos; posteriormente se identificaron en extractos acuosos y butanólicos el kaempferol-3-O-soforósido, kaempferol-3,7-di-O-ß-glucósido, cafeoil-metilato-4-ß-glucopiranósido y el kaempferol-3-O-soforosido-4'-O-ß -glucósido. Los efectos antidiabéticos de los extractos crudos y flavonoides de E. myriochaetum se demostraron en ratas diabéticas inducidas por STZ. La prueba exhibió una actividad significativa desde 60 hasta 180 min para los extractos butanólicos y acuosos. El efecto más potente se demostró por kaempferol-3-O-soforosido-4'-O-ß-glucósido.19
De modo complementario, el extracto acuoso de esta planta demostró un decremento significativo en los niveles de glucosa en sangre en pacientes con DM2. El efecto hipoglucemiante comenzó 90 min después de la administración del extracto y se mantuvo durante otros 90 min. Contrario a lo que se pensaba, los niveles de insulina no cambiaron de forma significativa durante el estudio, lo cual sugiere un mecanismo de acción distinto a la insulinogénesis.20 Un aspecto interesante de esta planta es que no muestra citotoxicidad en un máximo de 3 700 ppm.21
Familia Euphorbiaceae
Cnidoscolus chayamansa Mc Vaugh
C. chayamansa, comúnmente conocida como "chaya", es una planta muy usada y recomendada en el estado para el tratamiento de la DM2. El extracto etanólico de hojas de C. chayamansa contiene alrededor de 71,3 ± 1,7 mg de ácido gálico/g de extracto y 42,6 ± 37 mg de catequina/g de extracto; también 0,242 ± 0,001 mg/g de ácido protocatecuico y 2,0 ± 0,097 mg/g de rutina y 0,017±0,002 mg ácido cianhídrico/g hoja.22,23 En ratas diabéticas inducidas por aloxano el efecto hipoglucemiante (< 200 mg/dL) fue reportado para el extracto a dosis de 0,5 a 1,5 g/kg, este ejerce también una disminución en los niveles de triacilgliceroles (80-90 mg/dL) y colesterol (88-96 mg/dL).24 Sin embargo, y debido a su contenido de ácido cianhídrico, las hojas de chaya deben cocerse preferentemente antes de consumirse.23
Familia Lamiaceae
Hyptis suaveolens (L.) Poit.
El extracto hidroalcohólico 50 % (HSE)
de las hojas de H. suaveolens presenta fuertes propiedades antioxidantes
y antidiabéticas.25 Los principios activos identificados hasta
el momento corresponden a compuestos de bajo peso molecular, como son![]() -pineno,
sabineno, ß-pineno, 1-octen-3-ol, ß-myrceno,
-pineno,
sabineno, ß-pineno, 1-octen-3-ol, ß-myrceno,![]() -terpineno,
limoneno, 1,8cineol,
-terpineno,
limoneno, 1,8cineol,![]() -terpineno,
-terpineno,![]() -terpinoleno,
terpinen-4-ol, ß-cariofileno,
-terpinoleno,
terpinen-4-ol, ß-cariofileno,![]() -bergamoteno,
-bergamoteno,![]() -humuleno,
biciclogermacreno y fenantreno.26 El efecto hipoglucemiante del HSE
fue comprobado en un estudio realizado con ratas diabéticas inducidas
por STZ. La dosis oral era de 250 y 500 mg/kg/día durante 21 días
y al término de este período se observó una reducción
significativa de la glucosa en sangre en comparación del grupo control
que no mostró reducción. Adicionalmente se reporta una disminución
de los niveles de triglicéridos, colesterol total, lipoproteínas
de baja densidad y lipoproteínas de muy baja densidad. Los resultados
muestran que el HSE posee actividad hipoglucemiante, pero no se debe descartar
el efecto de los antioxidantes que contiene.27
-humuleno,
biciclogermacreno y fenantreno.26 El efecto hipoglucemiante del HSE
fue comprobado en un estudio realizado con ratas diabéticas inducidas
por STZ. La dosis oral era de 250 y 500 mg/kg/día durante 21 días
y al término de este período se observó una reducción
significativa de la glucosa en sangre en comparación del grupo control
que no mostró reducción. Adicionalmente se reporta una disminución
de los niveles de triglicéridos, colesterol total, lipoproteínas
de baja densidad y lipoproteínas de muy baja densidad. Los resultados
muestran que el HSE posee actividad hipoglucemiante, pero no se debe descartar
el efecto de los antioxidantes que contiene.27
Marrubium vulgare L.
Las hojas de M. vulgare conocido vulgarmente como "marrubio" contienen 34 componentes incluidos a-eudesmol, ß-citronelol, formiato de citronelilo y germacreno D, que son considerados antioxidantes muy eficientes.28 Al investigar los efectos hipoglucémicos producidos por la administración de diversos extractos etanólicos (raíz, hoja y tallo) de M. vulgare (REE) en ratas normoglucémicas, los resultados indicaron que 2 extractos (raíz y tallo) produjeron reducciones significativas de glucosa en plasma, después de la administración oral a una dosis de 100 mg/kg. Estos resultados sugieren que el REE podría ejercer su efecto antidiabético por la supresión de la absorción de hidratos de carbono en el intestino y reduciendo de este modo el aumento posprandial de la glucosa en sangre.29
Por otra parte, existe evidencia de que el extracto de M. vulgare contiene ciertas cantidades de flavonoides con actividad antioxidante, como la luteolina, apigenina, 2"-O-ß glucuronido y 2"-O-ß glucósidos, además de vicenina y vitexina.30 Estudios sobre la administración del extracto metanólico a dosis oral de 500 mg/kg/día de M. vulgare durante 28 días en ratas diabéticas inducidas con STZ, demostraron una reducción significativa en el nivel de glucosa en sangre a partir de la segunda semana; de igual manera mostró un aumento evidente en la insulina plasmática y el glucógeno. También se presentó una reducción significativa de lipoproteínas de baja densidad, así como un aumento de las lipoproteínas de alta densidad.31
Salvia splendens Ker Gawl.
Los metabolitos secundarios de diversas especies
de Salvia incluida S. splendens son en parte flavonoides como
salvigenina, quercetina, luteolina, apigenina y luteolina-7-O-glucósido
y, principalmente, los terpenos como oleato de sitosterol, ß-sitosterol, estigmasterol,
manool, 7![]() -acetoxi
roileanona, el ácido ursólico, el ácido oleanólico,
ácido 3 epicorosólico, ácido 3-epimaslinico y ácido
coleonólico.32,33 Estos se encuentran contenidos mayoritariamente
en las partes aéreas (flores y hojas). Los extractos acuosos y metanólicos
de S. splendens obtenidos de las partes aéreas redujeron significativamente
la glucemia en ratas diabéticas inducidas por STZ a dosis orales de 100
y 200 mg/kg, respectivamente. Se sugiere que la actividad hipoglucemiante de
los extractos acuoso y metanólico de S. splendens podría
deberse a la presencia de altas cantidades de antocianinas, flavonoides y compuestos
fenólicos.34 De manera coincidente, el ácido ursólico
fue detectado en esta planta y con evidencia científica que avala su
efecto hipoglucemiante, también está presente T. stans
y Lantana camara. El compuesto podría contribuir en cierto grado
al efecto antidiabético de esta planta.
-acetoxi
roileanona, el ácido ursólico, el ácido oleanólico,
ácido 3 epicorosólico, ácido 3-epimaslinico y ácido
coleonólico.32,33 Estos se encuentran contenidos mayoritariamente
en las partes aéreas (flores y hojas). Los extractos acuosos y metanólicos
de S. splendens obtenidos de las partes aéreas redujeron significativamente
la glucemia en ratas diabéticas inducidas por STZ a dosis orales de 100
y 200 mg/kg, respectivamente. Se sugiere que la actividad hipoglucemiante de
los extractos acuoso y metanólico de S. splendens podría
deberse a la presencia de altas cantidades de antocianinas, flavonoides y compuestos
fenólicos.34 De manera coincidente, el ácido ursólico
fue detectado en esta planta y con evidencia científica que avala su
efecto hipoglucemiante, también está presente T. stans
y Lantana camara. El compuesto podría contribuir en cierto grado
al efecto antidiabético de esta planta.
Familia Aloaceae
Aloe vera L.
El análisis de Aloe vera mostró un contenido de cromo, manganeso, zinc, vitaminas C y E, a los que se les atribuye la actividad antidiabética.35 Además se encontró aloemodina y emodina, que son antraquinonas responsables del efecto antioxidante de esta planta.36 Al administrar el extracto en gel a dosis de 0,5 mL/día durante 5 semanas en ratas normales y diabéticas inducidas por aloxano, se obtuvo una disminución significativa de glucosa en suero, colesterol total y triglicéridos. De igual manera, se presentó una disminución importante en los niveles séricos de malondialdehído y un aumento de óxido nítrico en suero. 35
Familia Cecropiaceae
Cecropia obtusifolia Bertol.
Entre los compuestos activos que se han aislado de C. obtusifolia están el sitosterol, estigmasterol, 4-etil-5-(n-3valeroil)-6-hexahidrocoumarina, 1-(2-metil-1-nonen-8-il)-aziridina, el ácido clorogénico y la isoorientina.37,38 Estudios llevados a cabo con ácido clorogénico en microsomas hepáticos de rata demuestran que es un inhibidor específico del complejo enzimático de la glucosa-6-fosfatasa.39 En ratas diabéticas el extracto acuoso de C. obtusifolia reveló efectos hipoglucemiantes significativos entre los 60 y 180 min después de su administración. Posteriormente, un estudio efectuado en 12 pacientes con DM2 (con dosis de 13,5 g planta/día en 1 L de agua por 32 semanas) demostró que a tan solo 4 semanas después de comenzar la administración del extracto acuoso de C. obtusifolia, existe efecto hipoglucemiante significativo y sostenido hasta las 32 semanas. Además, se demostró que los extractos de esta planta no producen algún efecto genotóxico al realizar ensayos in vivo en micronúcleos de linfocitos cultivados de seres humanos. Estos se obtuvieron a partir de 6 pacientes diagnosticados con DM2 que fueron tratados diariamente con 13,5 g del extracto acuoso, durante un período de 32 a 85 días.38
Cecropia peltata T.
Alternativamente C. peltata es usada también como agente hipoglucemiante, pero su efecto es menor que C. obtusifolia, este fenómeno podría correlacionarse con el contenido de ácido clorogénico en ambas especies, porque C. obtusifolia contiene 19,84 ± 1,64 mg de ácido clorogénico/g a comparación a 13,3 ± 3,2 mg/g de C. peltata.40
Familia Musaceae
Musa paradisiaca L. y Musa sapientum L.
El fruto verde de M. paradisiaca contiene altos niveles de potasio y sodio que se relacionan con un aparente efecto insulinogénico. Las fibras procedentes de la fruta verde de M. paradisiaca aumentan la glucogénesis en el hígado, así como también disminuyen la glucosa en sangre en ayunas. Adicionalmente, el extracto metanólico de la raíz de M. paradisiaca presenta también efectos antidiabéticos. Por otro lado, el extracto clorofórmico de flores de M. sapientum mostró una reducción de la hemoglobina glucosilada después de la administración oral en ratas y conejos, de igual forma controló la peroxidación de lípidos. La pectina aislada del jugo del tallo de M. sapientum y M. paradisiaca aumenta la síntesis de glucógeno, disminuye la glucogenólisis y gluconeogénesis.41
Familia Nyctaginaceae
Salpianthus macrodonthus Stand.
Estudios sobre la administración del extracto acuoso de S. macrodonthus en conejos diabéticos inducidos por aloxano demostraron una reducción en la curva de tolerancia a la glucosa en 15,0 %.42 En el grupo de Pérez-Gutiérrez43 identificaron que el saliriol era la sustancia activa responsable del efecto hipoglucemiante en el Salpianthus areanrius, es una planta del mismo género y comparte este compuesto activo, por lo que el efecto hipoglucemiante de S. macrodonthus quizá involucre la participación del saliriol. Experimentos fitoquímicos posteriores son necesarios para comprobar este supuesto.
Familia Rhamnaceae
Colubrina elliptica (Sw.) Briz. & WL Stern
Marroquín44 y su grupo de trabajo compararon el efecto de los extractos acuosos de C. elíptica con tolbutamida y glibenclamida en ratas sanas sometidas a ayuno por 18 h, para posteriormente inyectarles glucosa subcutánea 50 % (2 g/kg de peso), logrando desencadenar hiperglucemia temporal. Los resultados exponen que el extracto contiene propiedad hipoglucemiante desde los 60 min con un pico máximo a los 120 min, a diferencia de los fármacos de patente usados como control, en los cuales el pico máximo fue a los 300 min. El extracto de C. elíptica mostró un efecto rápido similar al de la glibenclamida, lo cual sugiere que su acción es a nivel del páncreas, estimulando la producción de insulina. Cruz-Gallegos45 realizó un estudio de los principales flavonoides de la planta, pero no reporta algún efecto hipoglicemiante por la acción de estos. Un escrutinio fitoquímico podría brindar mayor información y una nueva corroboración sobre los experimentos con los flavonoides identificados ayudaría a localizar al compuesto bioactivo.
Familia Rhizophoraceae
Rhizophora mangle L.
La química de R. mangle muestra que existen grandes cantidades de polifenoles, que en su mayoría son los taninos quercetina, catequina, rutina, epicatequina, ácido clorogénico, ácido galico y ácido elalico.46 El efecto hipoglucemiante se comprobó al suministrar extracto acuoso de los tallos (4 mL/kg) en conejos sometidos a ayuno por 18 h, y posteriormente al aplicarles una solución de glucosa subcutánea. El extracto disminuyó en 16,3 % la curva de tolerancia a la glucosa.47 Adicionalmente a la actividad antioxidante del extracto acuoso de la corteza de R. mangle, este ejerció una acción eliminadora especifica de radicales hidroxilo así como la habilidad de quelar iones de hierro; también disminuyó el daño oxidativo en las moléculas de ADN.46,48 La química identificada de R. mangle sugiere que el ácido clorogénico podría ser uno de los compuestos involucrados en el efecto hipoglucemiante, porque como se mencionó antes, es un inhibidor específico del complejo enzimático de la glucosa-6-fosfatasa.39
Familia Rosaceae
Eriobotrya japonica (Thunb.) Lindl.
Eriobotrya japonica contiene un sesquiterpeno
glucosilado (Nerolidol-3-O-![]() -l-rhamnopiranosil
(1—4)-
-l-rhamnopiranosil
(1—4)-![]() -l-rhamnopiranosil
(1—2)-[
-l-rhamnopiranosil
(1—2)-[![]() -l-rhamnopiranosil
(1—6)]-ß-d-glucopiranosido) proveniente de las hojas secas y también
contiene ácidos triterpénicos (TTA) (ácido tormentico,
ácido corosólico, ácido maslinico, ácido olcanoico,
ácido ursólico).49,50 En un estudio el sesquiterpeno
glucosilado se administró por vía oral en ratones normales (25
y 75 mg/kg), donde se comparó con la gliclazida como control (25 y 75
mg/kg). Los resultados indicaron una disminución significativa de la
glucosa sanguínea durante toda la prueba.49 También
se administraron TTA a dosis orales de 100, 200 hasta 300 mg/kg/día en
ratones diabéticos inducidos con aloxano y STZ por 7-14 días.
Los resultados revelaron que una dosis de 300 mg/kg de TTA es la más
efectiva en la disminución de los niveles de glucosa. De igual manera,
también presentaron efectos hipolipidémicos que reducen la hemoglobina
glucosilada en suero, colesterol total y los triglicéridos. Además,
el TTA incrementó la actividad de la superóxido dismutasa y el
nivel de insulina en suero.50 Estas evidencias indican que el TTA
de E. japonica tiene un potencial antidiabético e hipolipidémico
elevado, y podría deberse en parte al efecto que ejerce el ácido
ursólico que biosintetiza activamente.
-l-rhamnopiranosil
(1—6)]-ß-d-glucopiranosido) proveniente de las hojas secas y también
contiene ácidos triterpénicos (TTA) (ácido tormentico,
ácido corosólico, ácido maslinico, ácido olcanoico,
ácido ursólico).49,50 En un estudio el sesquiterpeno
glucosilado se administró por vía oral en ratones normales (25
y 75 mg/kg), donde se comparó con la gliclazida como control (25 y 75
mg/kg). Los resultados indicaron una disminución significativa de la
glucosa sanguínea durante toda la prueba.49 También
se administraron TTA a dosis orales de 100, 200 hasta 300 mg/kg/día en
ratones diabéticos inducidos con aloxano y STZ por 7-14 días.
Los resultados revelaron que una dosis de 300 mg/kg de TTA es la más
efectiva en la disminución de los niveles de glucosa. De igual manera,
también presentaron efectos hipolipidémicos que reducen la hemoglobina
glucosilada en suero, colesterol total y los triglicéridos. Además,
el TTA incrementó la actividad de la superóxido dismutasa y el
nivel de insulina en suero.50 Estas evidencias indican que el TTA
de E. japonica tiene un potencial antidiabético e hipolipidémico
elevado, y podría deberse en parte al efecto que ejerce el ácido
ursólico que biosintetiza activamente.
Familia Verbenaceae
Lantana camara L.
La química de L. camara muestra la presencia de flavonoides, fitoesteroles y saponinas. La evaluación de la actividad hipoglucemiante del extracto metanólico de L. camara se probó en ratas, administrando 100 y 200 mg/kg. El extracto de 200 mg/kg disminuyó de manera significativa el nivel de glucosa en sangre. No hubo ninguna reacción tóxica o letal en cualquiera de las dosis seleccionadas hasta el final del estudio.51 Un análisis fitoquímico del extracto metanólico de hojas, permitió el aislamiento del ácido urosólico oliato glucosilado, ácido ursólico estearato glucosilado, así como también el ácido oleanólico glucosilado. Algunos ésteres como undecanilo oleioato, dodecanil oleioato, ácidos carboxílicos como el ácido ursólico, además del ácido oleanólico. Al realizar pruebas en animales diabéticos con mezclas de ácido urosólico oliato glucosídico y ácido ursólico estearato glicosídico, se evidenció una reducción significativa en el nivel de glucosa sanguíneo.13 Estos resultados sugieren que los triterpenos glucosilados son potenciales agentes hipoglucémicos, controversialmente y de acuerdo con Venkatachalam51 se presenta una pérdida de peso colateral en las ratas ensayadas, por lo que son necesarios más estudios que permitan determinar la causa de este fenómeno.
Una gran parte de las plantas antidiabéticas
oaxaqueñas reportadas en este estudio sustentan un uso en la presencia
de algunos productos naturales, con actividad comprobada como es el caso del
ácido (4-hidroxi)-fenil acético, ß-D-O-glucósido,
ß-D-O-di (1-6) glucósido, kaempferol, ácido clorogénico,
así como el ácido ursólico. Estas evidencias fortalecen
y apoyan el uso empírico de algunas especies aquí tratadas y además,
exponen la necesidad de estudios más detallados en especies menos atendidas
fitoquímicamente, con el propósito de hallar nuevos componentes
individuales con efecto antidiabético. En otro contexto, en al menos
50 % de estas plantas existe evidencia sobre la presencia de estabilizadores
de radicales libres, como la luteolina, apigenina, ![]() -eudesmol,
ß-citronelol, aloemodina, emodina formiato de citronelilo y germacreno,
que podrían intervenir en el efecto hipoglucemiante de las plantas que
los contienen, porque el aumento del estrés oxidativo en la DM2 es propuesto
como una de las principales causas de la hiperglucemia. en un organismo, la
hiperglucemia estimula la formación de las especies reactivas de oxígeno
desde una variedad de fuentes. Estas fuentes incluyen la fosforilación
oxidativa, autooxidación de glucosa, NAD(P)H oxidasa, lipoxigenasa, monooxigenasas
citocromos P450, y sintetasa óxido nítrico. Se sabe que los islotes
pancreáticos contienen cantidades relativamente pequeñas de la
enzimas antioxidantes, como la superóxido dismutasa (SOD), varias de
sus formas comunes (CuZnSOD, Mn-SOD), catalasa y glutatión peroxidasa
(GPx). debido al bajo nivel de expresión de las enzimas antioxidantes,
las células ß están en un riesgo mayor del daño oxidativo
que los tejidos que tienen mayores niveles de protección antioxidante.25
Por las características patológicas de la DM2, el tratamiento
antioxidante puede ejercer efectos beneficiosos en la preservación de
la función de las células ß. El efecto de los extractos
crudos orgánicos y acuosos podría potenciar la propiedad antidiabética,
debido al sinergismo de muchas moléculas con actividad hipoglucemiante
disueltas en estos.
-eudesmol,
ß-citronelol, aloemodina, emodina formiato de citronelilo y germacreno,
que podrían intervenir en el efecto hipoglucemiante de las plantas que
los contienen, porque el aumento del estrés oxidativo en la DM2 es propuesto
como una de las principales causas de la hiperglucemia. en un organismo, la
hiperglucemia estimula la formación de las especies reactivas de oxígeno
desde una variedad de fuentes. Estas fuentes incluyen la fosforilación
oxidativa, autooxidación de glucosa, NAD(P)H oxidasa, lipoxigenasa, monooxigenasas
citocromos P450, y sintetasa óxido nítrico. Se sabe que los islotes
pancreáticos contienen cantidades relativamente pequeñas de la
enzimas antioxidantes, como la superóxido dismutasa (SOD), varias de
sus formas comunes (CuZnSOD, Mn-SOD), catalasa y glutatión peroxidasa
(GPx). debido al bajo nivel de expresión de las enzimas antioxidantes,
las células ß están en un riesgo mayor del daño oxidativo
que los tejidos que tienen mayores niveles de protección antioxidante.25
Por las características patológicas de la DM2, el tratamiento
antioxidante puede ejercer efectos beneficiosos en la preservación de
la función de las células ß. El efecto de los extractos
crudos orgánicos y acuosos podría potenciar la propiedad antidiabética,
debido al sinergismo de muchas moléculas con actividad hipoglucemiante
disueltas en estos.
De acuerdo al análisis de las 35 plantas utilizadas para la DM2 en Oaxaca, 24 (68,57 %) de ellas presentan algún estudio donde se comprueba la actividad hipoglucemiante y en 19 (51,42 %) se logró identificar el componente activo (tabla 2). De las 22 familias que se emplean para el tratamiento de la DM2, existe un mayor uso de las plantas de la familia Laminaceae con 17 %, seguido de las familias Cecropiaceae, Equisetaceae, cada una con 9 %. Por otra parte, las familias Asteraceae, Cactaceae, Musaceae y Leguminaceae presentan solo 6 % del total de plantas (Fig.). Dentro de la familia Equisetaceae, el género Equisetum (E. hyemale, E. laevigatum y H. myriochaeta) tiene una presencia elevada, sin embargo, solo en una se ha descrito el componente activo. Es importante mencionar que dadas las estrechas relaciones filogenéticas entre las especies de equisetos, la probabilidad de encontrar el compuesto hipoglucemiante activo como uno de tantos marcadores quimiotaxonómicos del género, es elevada.
CONCLUSIÓN
Para concluir, en el estado de Oaxaca existen al menos 35 especies de plantas usadas para el tratamiento de la DM2 que sustentan su uso tradicional a partir de ensayos in vitro o in vivo con modelos animales, o bien a través de la química hipoglucemiante de productos naturales. Sobre este último punto, se observa que para más de 50 % de las especies aquí descritas se revelan los compuestos químicos putativamente involucrados en los efectos antidiabéticos, que son sobre todo compuestos fenólicos y terpenos con actividad comprobada a partir de su identificación y aislamiento en las mismas plantas o en otras diferentes.
AGRADECIMIENTOS
Al proyecto CONACyT-CB-2010-151144Z por el apoyo otorgado. Carlos Jonnathan Castro Juárez agradece especialmente a la misma instancia por la beca otorgada para el desarrollo de su tesis de grado.
REFERENCIAS BIBLIOGRÁFICAS
1. Andrade-Cetto A, Wiedenfeld H. Anti-hyperglycemic effect of Opuntia streptacantha Lem. J Ethnopharmacol. 2011;133(2):940-3.
2. Becerra-Jiménez J, Andrade-Cetto A. Effect of Opuntia streptacantha Lem on alpha-glucosidase activity. J Ethnopharmacol. 2012;139(2):493-6.
3. Verner CR. Oral Hypoglycemic Agents: The usual way to proceed and special situations. Rev Med Clin Las Condes. 2009;20(5):595-602.
4. Hernández-Galicia E, Aguilar-Contreras A, Aguilar-Santamaría L, Román-Ramos R, Chávez-Miranda AA, García-Vega LM, et al. Studies on hypoglycemic activity of Mexican medicinal plants. Proc West Pharmacol Soc. 2002;45(1):118-24.
5. Andrade-Cetto A, Heinrich M. Mexican plants with hypoglycaemic effect used in the treatment of diabetes. J Ethnopharmacol. 2005;99(3):325-48.
6. Xiaorui Z. Regulatory situation of herbal medicines - A world wide review. Geneva: World health organization; 1998. p. 11.
7. Merina A, Sivanesan D, Hazeena BV, Sulochana V. Antioxidant and hypolipidemic effect of Plumeria rubra L. in alloxan induced hyperglycemic rats. E-J Chem. 2010;7(1):1-5.
8. Abad-Reyes A, Bahsas A, Delgado-Méndez P, Amaro-Luis JM, Neil TGH. Actividad antimicrobiana y estudio fitoquímico preliminar de Mandevilla veraguasensis (Seem.) Helms. (Apocynaceae). Avances Química. 2006;1(3):29-34.
9. Patel V, Chitra V, Prasanna P, Krishnaraju V. Hypoglycemic effect of aqueous extract of Parthenium hysterophorus L. in normal and alloxan induced diabetic rats. Indian J Pharmacol. 2008;40(4):183-5.
10. Alonso-Castro AJ, Zapata-Bustos R, Romo-Yañez J, Camarillo-Ledesma P, Gómez-Sánchez M, Salazar-Olivo LA. The antidiabetic plants Tecoma stans (L.) Juss. ex Kunth (Bignoniaceae) and Teucrium cubense Jacq (Lamiaceae) induce the incorporation of glucose in insulin-sensitive and insulin-resistant murine and human adipocytes. J Ethnopharmacol. 2010;127(1):1-6.
11. Glasby J. Dictionary of plants containing secondary metabolites. London: Taylor and Francis; 1991. p. 57, 264, 314.
12. Lozoya-Meckes M, Mellado-Campos V. Is the Tecoma stans infusion an antidiabetic remedy? J Ethnopharmacol. 1985;14(1):1-9.
13. Kazmi I, Afzal M, Anwar F. Characterization and anti-diabetic evaluation of Lantana camara. Ursolic acid derivative with potent pharmacological significance. Germany: LAP Lambert Academic Publishing; 2012. p. 144.
14. Aguilar-Santamaría L, Ramírez G, Nicasio P, Alegría-Reyes C, Herrera-Arellano A. Antidiabetic activities of Tecoma stans (L.) Juss. ex Kunth. J Ethnopharmacol. 2009;124(2):284-8.
15. Al-Azzawi AM. Genotoxic and cytotoxic study of Tecoma stans Bignoniaceae. Pakistan J Biol Sci. 2011;15(2):92-7.
16. Pérez-Gutiérrez RM, Mota FJM. Attenuation of hyperglycemia and hyperlipidemia in streptozotocin-induced diabetic rats by chloroform extract of fruits of Ferocactus latispinus and Ferocactus histrix. Bol Latinoam Caribe Plant Med Aromat. 2010;9(6):475-84.
17. Ramírez G, Zavala M, Pérez J, Zamilpa A. In vitro screening of medicinal plants used in Mexico as antidiabetics with glucosidase and lipase inhibitory activities. Evid Based Complement Alternat Med. 2012(1):0-6.
18. Andrade-Cetto A, Wiedenfel H. Hypoglycemic effect of Acosmium panamense bark on streptozotocin diabetic rats. J Ethnopharmacol. 2004;90(2-3):217-20.
19. Andrade-Cetto A, Wiedenfeld H, Revilla-Monsalve MC, Islas AS. Hypoglycemic effect of Equisetum myriochaetum aerial parts on streptozotocin diabetic rats. J Ethnopharmacol. 2000;72(1-2):129-33.
20. Revilla-Monsalve MC, Andrade-Cetto A, Islas-Andrade S, Wiedenfeld H. Hypoglycemic effect of Equisetum myriochaetum aerial parts on type 2 diabetic patients. J Ethnopharmacol. 2002;81(1):117-20.
21. Bárcenas-Rodríguez H. Determinación del efecto genotóxico de Equisetum myriochaetum en células somáticas de alas de Drosophila melanogaster [Tesis Licenciatura en Biología]. México: Facultad de Ciencias, UNAM; 2004.
22. Loarca-Piña G, Mendoza S, Ramos-Gómez M, Reynoso R. Antioxidant, antimutagenic, and antidiabetic activities of edible leaves from Cnidoscolus chayamansa Mc. Vaugh. J Food Sci. 2010;75(2):68-72.
23. Molina CA, Curley WL, Bressani R. Redescubriendo el valor nutritivo de las hojas de chaya (Cnidoscolus aconitifolius; Euphorbiaceae). Cienc Acción (Gua) [Internet]. 1997;(3). [aprox. 3 p] [citado 25 Ene 2013]. Disponible en: http://kirika.uvg.edu.gt/info-academica/u-academicas/inst-invest-old/boletin/b3/cienac3.html
24. Figueroa-Valverde L, Díaz-Cedillo F, Camacho-Luis A, López-Ramos M. Efeitos induzidos por Ruta graveolens L., Rutaceae, Cnidoscolus chayamansa McVaugh, Euphorbiaceae, e Citrus aurantium L., Rutaceae, nos níveis de glucose, colesterol e triacilglicerídeos num modelo do rato diabético. Braz J Pharmacogn. 2009;19(4):898-907.
25. Mazumder PM, Rathinavelusamy P, Sasmal D. Role of antioxidants in phytomedicine with special reference to antidiabetic herbs. Asian Pac J Trop Dis. 2012;2(S2):969-79.
26. Tachakittirungrod S, Chowwanapoonpohn S. Comparison of antioxidant and antimicrobial activities of essential oils from Hyptis suaveolens and Alpinia galanga growing in Northern Thailand. CMU J Nat Sci. 2007;6(1):31-41.
27. Mishra SB, Verma A, Mukerjee A, Vijayakumar M. Anti-hyperglycemic activity of leaves extract of Hyptis suaveolens L. Poit in streptozotocin induced diabetic rats. Asian Pac J Trop Med. 2011;4(9):689-93.
28. Kadri A, Zarai Z, Békir A, Gharsallah N, Damak M, Gdoura R. Chemical composition and antioxidant activity of Marrubium vulgare L. essential oil from Tunisia. Afr J Biotechnol. 2011;10(19):3908-14.
29. Vergara-Galicia J, Aguirre-Crespo F, Tun-Suarez A, Aguirre-Crespo A, Estrada-Carrillo M, Jaimes-Huerta I, et al. Acute hypoglycemic effect of ethanolic extracts from Marrubium vulgare. Phytopharmacology. 2012;3(1):54-60.
30. Nawwar MAM, El-Mousallamy AMD, Barakat HH, Buddrus J, Linscheid M. Flavonoid lactates from leaves of Marrubium vulgare. Phytochemistry. 1989;28(11):3201-6.
31. Elberry AA, Harraz FM, Ghareib SA, Gabr SA, Nagy AA, Abdel-Sattar E. Methanolic extract of Marrubium vulgare ameliorates hyperglycemia and dyslipidemia in streptozotocin-induced diabetic rats. Int J Diab Mellit [Internet] 2011 Feb. [aprox. 1 p] [citado 25 Ene 2013]. Disponible en: http://dx.doi.org/10.1016/j.ijdm.2011.01.004
32. Ibrahim TA. Chemical composition and biological activity of extracts from Salvia bicolor Desf. growing in Egypt. Molecules. 2012;17:11315-34.
33. Saeidnia S, Ghamarinia M, Gohari AR, Shakeri A. Terpenes from the root of Salvia hypoleuca Benth. DARU J Pharma Sci. 2012;20(1):0-6.
34. Mahesh KP, Sasmal D, Mitra MP. The antihyperglycemic effect of aerial parts of Salvia splendens (scarlet sage) in streptozotocin-induced diabetic-rats. Pharm Res. 2010;2(3):190-4.
35. Kamel MEA. Antidiabetic, antihypercholestermic and antioxidative effect of Aloe vera gel extract in alloxan induced diabetic rats. Aust J Basic Appl Sci. 2011;5(11):1321-7.
36. Vargas F, Díaz Y. Estudios in vitro de los mecanismos fotooxidantes y antioxidantes de los principios activos de la Aloe vera. Rev Fac Farm. 2003;45(1):65-8.
37. Argueta VA. Atlas de las Plantas de la Medicina Tradicional Mexicana. México: Instituto Nacional Indigenista; 1994. p. 3.
38. Andrade Cetto A. Mexican plants traditionally used for the treatment of type 2 diabetes. En: Hiriart-Urdanivia M, Mas-Oliva J, editores. Advances in obesity-diabetes research at UNAM. México: Manual Moderno; 2010. p.191-200.
39. Hemmerle H, Burger HJ, Below P, Schubert G, Rippel R, Schindler PW, et al. Chlorogenic acid and synthetic chlorogenic acid derivatives: Novel inhibitors of hepatic glucose-6-phosphate translocase. J Med Chem. 1997;40(2):137-43.
40. Nicasio P, Aguilar-Santamaría L, Aranda E, Ortiz S, González M. Hypoglycemic effect and chlorogenic acid content in two Cecropia species. Phytother Res. 2005;19(8):661-4.
41. Zafar-Imam M, Akter S. Musa paradisiaca L. and Musa sapientum L.: A phytochemical and pharmacological review. J Appl Pharm Sci. 2011;01(05):14-20.
42. Román-Ramos R, Flores-Sáenz JL, Partida-Hernández G, Lara-Lemus A, Alarcón-Aguilar F. Experimental study of the hypoglycemic effect of some antidiabetic plants. Arch Invest Med (Mex). 1991;22(1):87-93.
43. Pérez-Gutiérrez RM. Actividad hipoglucemiante de Salpianthus arenarius, Acrocomia mexicana, Agarista mexicana y Verbesina persicifolia [Tesis Doctorado en Ciencias Biológicas]. México: Universidad Autónoma Metropolitana, Unidad Iztapalapa; 1997.
44. Marroquín SR, Flores M, García M, Mora JL. Efecto antihiperglucémico de un extracto acuoso de Columbrina elíptica. Rev Mex Cienc Farm. 2005;36(6):27-32.
45. Cruz-Gallegos J. Relación flavonoides totales-actividad antidiabética (in vitro por difusión de glucosa) en extractos de Colubrina elliptica [Tesis Ingeniero en Alimentos]. Huajuapan de León, Oaxaca, México: Universidad Tecnológica de la Mixteca; 2012.
46. Sánchez J, Martínez G, García F. Efecto protector de los polifenoles de Rhizophora mangle L. sobre el daño oxidativo a proteínas y ADN. Rev Cubana Plant Med. 2011;16(1):1-12.
47. Alarcón-Aguilara FJ, Román-Ramos R, Pérez-Gutiérrez S, Aguilar-Contreras A, Contreras-Weber CC, Flores-Saenz JL. Study of the anti-hyperglycemic effect of plants used as antidiabetics. J Ethnopharmacol. 1998;61:101-10.
48. Sánchez J, Melchor G, Martínez G, Escobar A, Faure R. Antioxidant activity of Rhizophora mangle bark. Fitoterapia. 2006;77(2):141-3.
49. Chen J, Li WL, Wu JL, Ren BR, Zhang HQ. Hypoglycemic effects of a sesquiterpene glycoside isolated from leaves of loquat (Eriobotrya japonica (Thunb.) Lindl.). Phytomedicine. 2007;15(1-2):98-102.
50. Lü H, Chen J, Li JL, Ren BR, Wu JL, Kang HY, et al. Hypoglycemic and hypolipidemic effects of the total triterpene acid fraction from Folium eriobotryae. J Ethnopharmacol. 2009;122(3):486-91.
51. Venkatachalam T, Kishor KV, Kalai SP, Maske A, Anbarasan V, Siva KP. Antidiabetic activity of Lantana camara Linn fruits in normal and streptozotocin induced diabetic rats. J Pharm Res. 2011;4(5):1550-2.
52. Padilla Gómez E. Estudio ecológico y etnobotánico de la vegetación del municipio de San Pablo Etla, Oaxaca [Tesis Maestro en Ciencias de Conservación y Aprovechamiento de Recursos]. México: Instituto Politécnico Nacional; 2007.
53. Aguilar A, López-Villafranco ME, Xolalpa-Molina S. Los tratamientos populares y el personal de salud. Relevancia de la herbolaria. Servicios de Salud con Calidad Intercultural en Pueblos Amerindios. 2003 [citado 13 enero 2013]: 1-93. [aprox. 5 p]. Disponible en: http://bvs.per.paho.org/texcom/cd048358/tratamie.pdf
54. Cervantes-Servín L, Valdez Gutiérrez J. Plantas medicinales del distrito de Ocotlán Oaxaca. Anales Inst Biol UNAM Ser Bot. 1990;60(1):85-103.
55. Pérez-García V. Plantas medicinales de uso en traspatio de la zona centro del estado de Veracruz [Tesis licenciado en biología]. Veracruz, México: Universidad Veracruzana; 2009.
56. Biblioteca digital de la medicina tradicional mexicana. [Internet] UNAM [citado 25 Ene 2013]. [aprox. 3 p]. Disponible en: http://www.medicinatradicionalmexicana.unam.mx
57. CONABIO. [Internet]. Herbario virtual [citado Ene 25 2013]. [aprox. 5 p]. Disponible en: http://www.conabio.gob.mx/otros/cgi-bin/herbario.cgi
58. Gallardo-Pérez JC, Esparza-Aguilar Ml, Gómez-Campos A. Importancia etnobotánica de una planta vascular sin semilla en México: Equisetum. Polibotanica. 2006;21:61-74.
59. Bautista-Cruz A, Arnaud-Viñas MR, Martínez-Gutiérrez GA, Sánchez-Medina PS, Pérez Pacheco R. The traditional medicinal and food uses of four plants in Oaxaca, Mexico. J Med Plants Res. 2011; 5(15):3404-11.
Recibido: 31 de marzo de 2013.
Aprobado: 8 de julio de 2013.
Nemesio Villa Ruano. Universidad de la Sierra Sur. Guillermo Rojas Mijangos S/N col. Cd Universitaria, CP 70800, Miahuatlán de Porfirio Díaz. Oaxaca, México. (+52) 951572410. Correo electrónico: necho82@yahoo.com.mx