ARTÍCULO ORIGINAL
Efecto de tres plantas afrodisíacas sobre la movilidad in vitro de los espermatozoides humanos
In vitro effect of three aphrodisiac plants on human sperm motility
Rosario Angulo Paternina,I Luisa Ospina Medina,I Victor Arango Valencia,II Walter D. Cardona MayaI
I
Grupo Reproducción, Facultad de Medicina, Universidad de Antioquia. Medellín,
Colombia.
II Grupo
Productos Naturales Marinos, Universidad de Antioquia. Medellín, Colombia.
RESUMEN
Introducción:
Algunas plantas usadas por sus propiedades afrodisiacas han probado que tienen
efecto potenciador sobre la movilidad in vitro de los espermatozoides.
Lepidium meyenii Walpers, Paullinia cupana Kunth y Bactris
gasipaes Kunth son plantas de origen tropical conocidas culturalmente como
afrodisiacos.
Objetivo:
Determinar el efecto que tienen los extractos acuosos y etanólicos de Lepidium
meyenii Walpers, Paullinia cupana Kunth y Bactris gasipaes
Kunth sobre la movilidad in vitro de los espermatozoides humanos.
Métodos:
Las plantas fueron recolectadas y evaluadas por un botánico experto. Se
desecaron y se prepararon los extractos acuosos en solución salina al 0,85
% durante 48 horas. Para preparar los extractos etanólicos, el material
vegetal se mezcló con 50 mL de etanol puro durante 48 horas, luego de evaporado
el solvente se redisolvió en dimetilsulfóxido con solución salina
al 0,85 % en proporción 1:9 v/v. Por último, los extractos se diluyeron
en solución salina en una concentración de 20 mg/mL y se almacenaron
a -20 °C hasta su uso. Las muestras de semen de hombres normozoospérmicos
fueron expuestas a los extractos acuosos y etanólicos de cada planta con
el objetivo de evaluar el efecto sobre la movilidad de los espermatozoides y
sus parámetros cinemáticos. También se determinó la composición
fitoquímica de los extractos de cada planta.
Resultados:
El extracto etanólico de L. meyenii provocó la disminución
notable de la movilidad espermática a los 120 min y el extracto acuoso
de B. gasipaes (20 mg/mL) causó la aglutinación inmediata de
los espermatozoides.
Conclusiones:
Los extractos de L. meyenii, P. cupana y B. gasipaes no
tienen efecto activador in vitro sobre los espermatozoides humanos. Sin
embargo, el efecto aglutinante del extracto acuoso de B. gasipaes podría
aprovecharse para fabricar anticonceptivos.
Palabras clave: Lepidium meyenii Walpers; Paullinia cupana Kunth; Bactris gasipaes Kunth; movilidad espermática; productos naturales.
ABSTRACT
Introduction:
Some plants used for their aphrodisiac properties have proven to have an enhancing
effect on sperm motility in vitro. Lepidium meyenii Walpers, Paullinia
cupana Kunth and Bactris gasipaes Kunth are tropical plants popularly
known as aphrodisiacs.
Objective:
Determine the effect of acqueous and ethanolic extracts from Lepidium meyenii
Walpers, Paullinia cupana Kunth and Bactris gasipaes Kunth
on human sperm motility in vitro.
Methods:
The plants were collected and evaluated by a botanical expert. Next they were
desiccated and aqueous extracts were prepared by immersion in 0.85% saline solution
for 48 hours. To prepare the ethanolic extracts, the plant material was mixed
with 50 ml pure ethanol for 48 hours, and upon evaporation of the solvent, redissolved
in dimethyl sulfoxide and 0.85% saline solution in a proportion of 1:9 v/v.
Finally, the extracts were diluted with saline solution at a concentration of
20 mg/ml and stored at -20 °C until they were used. Samples of semen from
normozoospermic men were exposed to the aqueous and ethanolic extracts of each
plant to evaluate their effect on sperm motility and kinematic parameters. Determination
was also made of the phytochemical composition of the three extracts.
Results:
The ethanol extract of L. meyenii caused a significant reduction in sperm
motility at 120 minutes, whereas the aqueous extract of B. gasipaes (20
mg/mL) produced immediate sperm agglutination.
Conclusions:
L. meyenii, P. cupana and B. gasipaes extracts do not have
an activating effect on human spermatozoa in vitro. However, the agglutinating
effect of B. gasipaes aqueous extract could be taken advantage of to
manufacture contraceptives.
Key words: Lepidium meyenii Walpers, Paullinia cupana Kunth, Bactris gasipaes Kunth, sperm motility, natural products.
INTRODUCCIÓN
Los productos naturales obtenidos de algunas plantas han sido empleados históricamente para el tratamiento de enfermedades. Según reportes de la Organización Mundial de la Salud, una gran parte de la población mundial utiliza las plantas para tratar las enfermedades que afectan su salud,1 entre las cuales se incluyen las alteraciones de la salud sexual y reproductiva.2
Las plantas se han utilizado como espermicidas,3-7 supresoras de la espermatogénesis 8, 9 y, en la actualidad, se usan con el fin de reemplazar compuestos de origen sintético como el Nonoxinol-9, el espermicida de mayor uso, el cual causa efectos colaterales como inflamación, ulceración genital e incremento de la probabilidad de infección con el VIH debido a su uso frecuente.10-13
Los afrodisiacos se han usado en beneficio de la salud sexual y reproductiva y se consideran sustancias o alimentos que pueden acrecentar el deseo y el placer sexual,10 potenciar la erección del pene mediante cambios hormonales o incrementar el flujo sanguíneo y la relajación de los cuerpos cavernosos.2 Varias plantas usadas tradicionalmente como afrodisiacos [Radix acanthopanacis Senticosi (RAS), Astragalus membranaceus Fisch11 y Mondia whitei Hook. f12] han demostrado incrementar la movilidad in vitro de los espermatozoides humanos. En los países tropicales, incluido Colombia, existe una gran diversidad vegetal y cultural, lo cual ha permitido el uso de plantas como Lepidium meyenii, Paullinia cupana y Bactris gasipaes como afrodisiacos. L. meyenii (maca), una brasicacea originaria de los Andes peruanos, se usa tradicionalmente para mejorar la respuesta sexual y tratar la infertilidad. Se ha demostrado que la administración del extracto lipídico de la planta mejora la función sexual en los roedores,13 en humanos se demostró que su consumo en cápsulas (1 500 y 3 000 mg/d) durante cuatro meses incrementa notablemente el volumen, la concentración y el porcentaje de la movilidad espermática.14,15
P. cupana (guaraná) es una sapindácea originaria de la región amazónica reconocida por sus propiedades como estimulante del sistema nervioso y se usa como tónico para el dolor de cabeza y como diurético,16 y tiene actividad antioxidante, antimicrobiana, anticancerígena y antidepresiva.17 Un estudio en conejos evidenció que los extractos de esta planta incrementan la relajación de los cuerpos cavernosos y las concentraciones de adenosín monofosfato cíclico (AMPc), características claves en el proceso de erección del pene 18 y su actividad biológica ha sido atribuida a los altos contenidos de cafeína, teofilina y teobromina que son a su vez inhibidores de las fosfodiesterasas,16,19 las cuales han mostrado tener efectos positivos sobre la movilidad espermática in vitro.20 Por otra parte, B. gasipaes (chontaduro), una arecácea originaria de bosque lluvioso que crece en América Central y América del Sur,21 es un fruto conocido por contener carotenoides, por su actividad antioxidante, su bajo índice glicémico y alto contenido energético;22 sin embargo, a pesar de su valioso poder nutricional 23 no se conoce ninguna actividad biológica sobre ningún tipo de células.
Ya que se conocen las propiedades de estas tres plantas y su posible uso beneficioso para la reproducción humana, el objetivo de este estudio es determinar el efecto de los extractos acuosos y etanólicos de L. meyenii, P. cupana y B. gasipaes sobre la movilidad in vitro de los espermatozoides humanos.
MÉTODOS
Muestras de semen
Las muestras de semen fueron donadas por voluntarios de la ciudad de Medellín mayores de edad, aparentemente sanos, después de un periodo de abstinencia sexual de 2 a 5 días. Sólo se utilizaron las muestras con parámetros seminales iguales o superiores a los límites inferiores de referencia establecidos por la OMS en el año 2010 en el Manual para el análisis seminal.24 El proyecto fue aprobado por el Comité de Bioética para la investigación en humanos de la Sede de Investigación Universitaria de la Universidad de Antioquia. A cada participante se les explicaron las características del estudio y lo que estuvieron de acuerdo, firmaron el consentimiento para participar en el estudio,.
Análisis de las muestras de semen
Después de licuar las muestras seminales (entre 30 y 60 min) se evaluaron las características macroscópicas del semen: el pH, la cantidad, el color y la consistencia, y los parámetros microscópicos de los espermatozoides: movilidad, viabilidad y concentración. Para determinar la movilidad espermática en el microscopio de luz (Nikon Eclipse, Japón) se realizó un conteo por duplicado como mínimo de 200 espermatozoides en 10 µL de muestra de semen. La movilidad se clasificó como movilidad tipo I: espermatozoides con movilidad progresiva; movilidad tipo II: espermatozoides con movilidad no progresiva y movilidad tipo lll: espermatozoides inmóviles. Se anotó la movilidad de la muestra sin tratamiento antes y después de evaluar el efecto de los extractos. Para evaluar la viabilidad se mezclaron 10 µL de la muestra seminal con 10 µL del colorante vital eosina-Y 0,5 % (Sigma-Aldrich, EUA) y se discriminaron como espermatozoides vivos los que no incorporaron el colorante. La concentración de espermatozoides por mL se determinó utilizando la cámara de Makler (Sefi-Medical Instruments, Israel).25
Obtención del material vegetal
El fruto maduro de Bactris gasipaes Kunth (Herbario Universidad de Antioquia: HUA-196235) se había recolectado en marzo de 2014 en el departamento del Cauca, Colombia, y se adquirió en un mercado local. El mesocarpo del fruto se secó en un horno a 40 °C durante 24 h, se maceró y se redujo a polvo. El material pulverizado de P. cupana y de L. meyenii se obtuvo de proveedores certificados en el cultivo de plantas en la ciudad de Leticia, Colombia, y en Lima, Perú, respectivamente.
Obtención de los extractos acuosos y etanólicos
Se pesó cada extracto para preparar una solución de 20 mg/mL mediante percolación en solución salina al 0,85 % (Corpaul®, Colombia) durante 48 h y se filtró dos veces. Para elaborar los extractos etanólicos, el material vegetal previamente desecado se mezcló con 50 mL de etanol puro (J.T Baker, Xalostoc, México) durante 48 h, posteriormente se permitió la evaporación del solvente en una cabina de extracción y se resuspendió en dimetil sulfóxido (Sigma-Aldrich, EUA) con solución salina al 0,85 % en una proporción 1:9 v/v. Finalmente, los extractos se diluyeron en solución salina a una concentración de 20 mg/mL y se almacenaron a -20 °C hasta su uso.
Evaluación del efecto de los extractos sobre la movilidad de los espermatozoides
Para determinar la movilidad espermática mediante el método convencional se mezclaron 30 µL de cada extracto con 30 µL de semen para obtener una relación 1:1 v/v. Se tomaron 10 µL de la mezcla, se observó y se consideraron los distintos tipos de movilidad espermática por duplicado a los 5, 10, 60 y 120 min. Todos los ensayos se realizaron como mínimo tres veces.3,6
Para determinar la movilidad espermática mediante el sistema asistido por computador, se evaluaron 10 µL de la mezcla de las muestras de semen con los diferentes extractos (relación 1:1 v/v) en la cámara de Makler usando un microscopio de luz (Nikon, Eclipse, Japón) y una cámara fotográfica (Nikon, DS-Fi1, Japón). Se analizaron quince fotografías secuenciales durante 2 seg de acuerdo con los cambios relativos de posición según las coordenadas XY de los puntos seleccionados por el cursor y la distancia entre puntos sucesivos en el programa de uso libre Image J, mediante el complemento Manual Tracking según una metodología previamente estandarizada en nuestro laboratorio.25 Este método, además de permitir cuantificar cada uno de los tipos de movilidad en los espermatozoides, permitió determinar tres parámetros cinemáticos: la velocidad rectilínea (VSL), la velocidad curvilínea (VCL) y el índice de linealidad (LIN= VSL/VCL).
Marchas fitoquímicas
Se determinaron en los extractos etanólicos los siguientes compuestos: flavonoides, cumarinas, saponinas, compuestos fenólicos, leucoantocianidinas, taninos, titerpenos o esteroides, cardiotónicos, quinonas y alcaloides.26, 27 En el extracto acuoso no fue posible detectar estos compuestos debido a problemas metodológicos y técnicos.
Análisis estadístico
Se realizó un análisis descriptivo para determinar los valores de la media y la desviación estándar de la movilidad espermática antes y después de la incubación con los extractos. Para evaluar el efecto de los extractos sobre los espermatozoides se realizó una prueba ANOVA no paramétrica (prueba de Friedman) y la prueba de Dunns a posteriori. Se evaluó la relación entre los datos obtenidos mediante el método convencional y el método asistido por computador mediante la correlación de Spearman. Los análisis se realizaron empleando el programa estadístico GraphPad Prism 5.0 (GraphPad Software, San Diego, CA, EUA) y se consideró un nivel mínimo de significancia del 95 %, valor p ≤ 0,05.
RESULTADOS
Al contacto con los extractos acuosos de L. meyenii y P. cupana el porcentaje de inmovilidad espermática tendió a mantenerse por debajo del valor inicial de las muestras sin tratamiento. A pesar de no ser significativo, el cambio en el porcentaje de inmovilidad de los espermatozoides tratados con los extractos etanólicos de L. meyenii y P. cupana presentó un aumento más evidente y se alcanzó la disminución máxima a los 120 min (tabla 1).
Respecto al extracto de B. gasipaes se observó una tendencia al aumento de la movilidad espermática en las muestras tratadas con el extracto en una concentración de 20 mg/mL hasta los 10 min de tratamiento, aunque este efecto no se observó a partir de los 60 min de contacto. Se observaron resultados similares con el tratamiento de las muestras con el extracto etanólico. El extracto acuoso de B. gasipaes en una concentración de 20 mg/mL causó la aglutinación de los espermatozoides en todas las muestras, lo cual no se observó con el extracto etanólico (tabla 1).
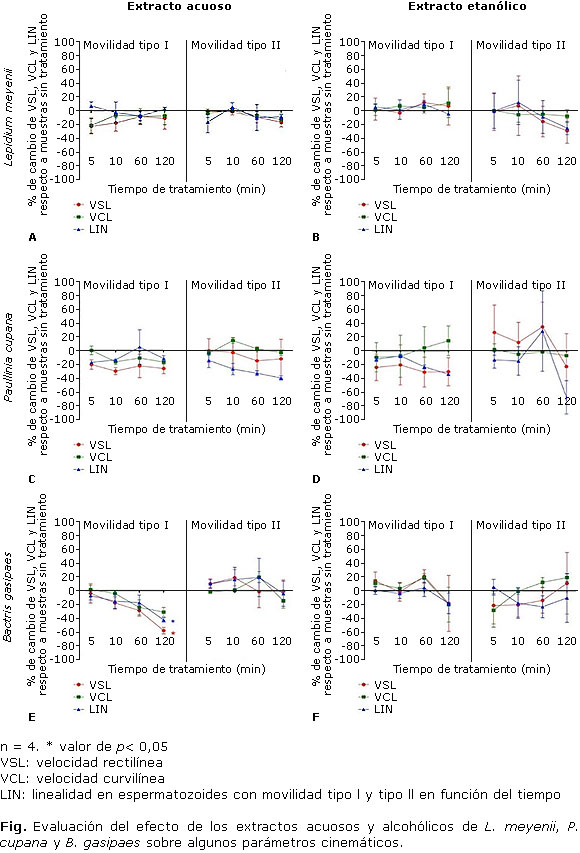
La velocidad rectilínea y el índice de linealidad tendieron a disminuir a los 120 min de tratamiento con el extracto etanólico de L. meyenii (Fig. 1A y 1B).
El extracto acuoso de P. cupana disminuyó el 30 % la VSL de los espermatozoides con movilidad tipo I y se observó una disminución progresiva del índice de linealidad en los espermatozoides con movilidad tipo II hasta casi 50 % a los 120 min de tratamiento (Fig. 1C). El extracto etanólico causó disminución inmediata de la VSL de los espermatozoides con movilidad tipo I, aunque se observó una respuesta más variable de los espermatozoides con movilidad tipo II (Fig. 1D).
El extracto acuoso de B. gasipaes causó una importante disminución de la velocidad rectilínea y, consecuentemente, del índice de linealidad de los espermatozoides con movilidad tipo I a los 120 min en comparación con la muestra sin tratamiento. Ambos parámetros disminuyeron de manera progresiva desde el tiempo inicial del tratamiento (Fig. 1F). Los espermatozoides móviles no progresivos no presentaron cambios notables en sus parámetros cinemáticos en comparación con la muestra inicial. No se observaron diferencias significativas en los parámetros cinemáticos a causa del extracto etanólico (Fig. 1E).
En la tabla
2 se muestran los resultados de la determinación de la composición
fitoquímica de los extractos de L. meyenii, P. cupana y B.
gasipaes.
DISCUSIÓN
La mayoría de las investigaciones sobre productos naturales de utilidad para la salud sexual y reproductiva en comparación con los productos farmacéuticos convencionales, se han enfocado en la búsqueda de alternativas para el tratamiento de distintos trastornos como la disfunción eréctil y la eyaculación precoz.28 En la literatura existen trabajos sobre las plantas afrodisíacas con posibilidades de mejorar la movilidad espermática in vitro que describen cómo los extractos mejoran los parámetros seminales2,29,30 tanto en animales como en humanos.
El criterio de selección de P. cupana se basó en sus propiedades como afrodisíaco y en su contenido de cafeína y de otros alcaloides derivados de las xantinas31 los cuales tienen efecto sobre la movilidad de los espermatozoides porque inhiben las fosfodiesterasas.32 Esta sitaución provoca el aumento de los valores de AMPc, lo que da como resultado un aumento de la energía disponible para la movilidad de los espermatozoides.20,33 Se plantea que el efecto positivo sobre la movilidad espermática se debe a la modulación del transporte de calcio,32 aunque en el presente estudio no se halló que los extractos de P. cupana afectaran positivamente la movilidad espermática a pesar de que se identificó la presencia de alcaloides.
Es necesario determinar si los extractos efectivamente contienen cafeína y los tipo de alcaloides presentes. Se ha demostrado que la acción farmacológica de estas sustancias depende de la concentración y que tienen un efecto más notorio en la potenciación de la movilidad de muestras con baja calidad inicial en comparación con las de hombres normozoospérmico.34 Debido a esto también resultaría interesante evaluar el efecto del extracto de los compuestos aislados sobre muestras de semen de hombres con diagnóstico de astenozoospermia.
Previamente se ha demostrado que el uso de L. meyenii promueve la fertilidad en distintas especies en cuanto al aumento del volumen de eyaculado.15 Específicamente en humanos se ha demostrado que después del consumo de tabletas de la planta L. meyenii durante 4 meses aumenta notablemente el volumen del eyaculado, así como de la movilidad y la concentración espermáticas.14
En este estudio, la incubación de los espermatozoides con los extractos acuoso y etanólico de L. meyenii no produjo efecto positivo sobre la movilidad espermática. Este resultado puede significar que los beneficios de esta planta para la reproducción en los hombres sólo se establecen cuando se administra por vía oral lo que no corresponde al efecto directo de un extracto sobre las células espermáticas. Por esto se concluye que L. meyenii tiene efecto estimulante in vivo, pero no in vitro.
El extracto acuoso de B. gasipaes causó la aglutinación de los espermatozoides; sin embargo, el calentamiento del extracto a 100 °C durante un minuto hizo que desapareciera esta propiedad aglutinante, lo cual permite concluir que las moléculas responsables de este efecto son termolábiles. García-Suárez y otros35 determinaron que el extracto acuoso de dos especies del género Bursera causan la aglutinación de los espermatozoides sin afectar la movilidad y la viabilidad. Estudios previos también demostraron que el extracto acuoso de Arum maculatum L. causa la aglutinación de los espermatozoides debido a la presencia de espermatoglutininas, proteínas del tipo lectina que causan la aglutinación del tipo cola-cola y cabeza-cola.36
En conclusión, los extractos de L. meyenii, P. cupana y B. gasipaes no producen efecto activador in vitro sobre los espermatozoides humanos. Sin embargo, el efecto aglutinante del extracto acuoso de B. gasipaes podría ser útil para fabricar anticonceptivos.
AGRADECIMIENTOS
Este trabajo fue financiado por el Comité para el Desarrollo de la Investigación (CODI, 2014-862), Universidad de Antioquia.
Conflicto de intereses
Los autores expresan que no tienen conflicto de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Rates S. Plants as source of drugs. Toxicon. 2001;39(5):603-13.
2. Melnyk JP, Marcone MF. Aphrodisiacs from plant and animal sources -A review of current scientific literature. Food Research International. 2011;44(4):840-50.
3. Gallego G, Henao D, Ospina L, Álvarez Gómez Á, Arango V, Cardona Maya W, et al. Efecto de cinco extractos de plantas colombianas sobre espermatozoides humanos. Rev Cubana Plant Med. 2012;17(1):84-92.
4. Alvarez-Gómez A, Cardona-Maya W, Castro-Alvarez J, Jiménez S, Cadavid A. Colombian plants with spermicidal activity, new options in anticonception: brief review. Actas Urológicas Españolas. 2007;31(4):372.
5. Alvarez-Gómez AM, Cardona-Maya W, Forero J, Cadavid AP. Human spermicidal activity of Passiflora edulis extract. Journal of Reproduction and Contraception. 2010;21(2):95-100.
6. Ospina Medina L, Álvarez Gómez Á, Arango Valencia V, Cadavid Jaramillo Á, Cardona Maya W. Actividad espermicida y citotóxica del extracto de Sapindus saponaria L. (jaboncillo). Rev Cubana Plant Med. 2013;18(2):187-200.
7. Uribe-Clavijo M, Álvarez-Gómez ÁM, Arango V, Cortes-Mancera FM, Cadavid-Jaramillo ÁP, Cardona-Maya WD. Efecto in vitro del Extracto Vegetal de Ananas comosus sobre Espermatozoides Humanos. Tecno Lógicas. 2012(28):55-70.
8. Lohiya N, Manivannan B, Mishra P, Pathak N, Sriram S, Bhande S, et al. Chloroform extract of Carica papaya seeds induces long-term reversible azoospermia in langur monkey. Asian Journal of Andrology. 2002;4(1):17-26.
9. Verma PK, Sharma A, Mathur A, Sharma P, Gupta R, Joshi S, et al. Effect of Sarcostemma acidum stem extract on spermatogenesis in male albino rats. Asian Journal of Andrology. 2002;4(1):43-8.
10. Kotta S, Ansari SH, Ali J. Exploring scientifically proven herbal aphrodisiacs. Pharmacognosy Reviews. 2013; 7(13):1-10.
11. Shalaweh S, Erasmus N, Weitz F, Henkel R. Effect of Cissampelos capensis rhizome extract on human spermatozoa in vitro. Andrologia. 2014;20:1-10.
12. Lampiao F, Krom D, Plessis SSd. The in vitro effects of Mondia whitei on human sperm motility parameters. Phytotherapy Research. 2008; 22(9):1272-3.
13. Shin B-C, Lee MS, Yang EJ, Lim H-S, Ernst E. Maca (L. meyenii) for improving sexual function: a systematic review. BMC Complementary and Alternative Medicine. 2010;10(1):44.
14. Gonzales GF, Cordova A, Gonzales C, Chung A, Vega K, Villena A. Lepidium meyenii (Maca) improved semen parameters in adult men. Asian Journal of Andrology. 2001;3(4):301-4.
15. Zheng BL, He K, Kim CH, Rogers L, Shao Y, Huang ZY, et al. Effect of a lipidic extract from Lepidium meyenii on sexual behavior in mice and rats. Urology. 2000;55(4):598-602.
16. Hamerski L, Somner GV, Tamaio N. Paullinia cupana Kunth (Sapindaceae): a review of its ethnopharmacology, phytochemistry and pharmacology. J Med Plants Res. 2013;7:2221-9.
17. Bittencourt L, Machado D, Machado M, Dos Santos G, Algarve T, Marinowic D, et al. The protective effects of guaraná extract (Paullinia cupana) on fibroblast NIH-3T3 cells exposed to sodium nitroprusside. Food and Chemical Toxicology. 2013;53:119-25.
18. Antunes E, Gordo W, De Oliveira J, Teixeira C, Hyslop S, De Nucci G. The relaxation of isolated rabbit corpus cavernosum by the herbal medicine Catuama® and its constituents. Phytotherapy Research. 2001;15(5):416-21.
19. Martins M, Kluczkovski AM, dos Santos ACS, Fernandes OC, Scussel VM. Evaluation of ochratoxin A and fungi in powdered guarana (Paullinia cupana Kunth), a caffeine rich product from Amazon forest. African Journal of Microbiology Research. 2014;8(6):545-50.
20. Tardif S, Madamidola OA, Brown SG, Frame L, Lefièvre L, Wyatt PG, et al. Clinically relevant enhancement of human sperm motility using compounds with reported phosphodiesterase inhibitor activity. Human Reproduction. 2014;29(10):2123-35.
21. Jiménez LN, Gómez G, Quesada S, Azofeifa G, Sorel Jatunov G. Carotenoids composition, antioxidant activity and glycemic index of two varieties of Bactris gasipaes. Emirates Journal of Food and Agriculture. 2011;23(6):482-9.
22. Urpí JM, Weber JC, Clement CR. Peach palm, Bactris gasipaes Kunth: Bioversity International; 1997.
23. Yuyama LK, Aguiar JP, Yuyama K, Clement CR, Macedo SH, Fávaro DI, et al. Chemical composition of the fruit mesocarp of three peach palm (Bactris gasipaes) populations grown in Central Amazonia, Brazil. International Journal of Food Sciences and Nutrition. 2003;54(1):49-56.
24. Cardona Maya W. Manual de procesamiento de semen humano de la Organización Mundial de la Salud-2010. Actas Urológicas Españolas 2010;34(7):577-8.
25. Cardona Maya W. Análisis cuantitativo del movimiento de espermatozoides humanos aplicando un programa de uso libre, estudio-piloto. Revista UDCA Actualidad & Divulgación Científica 2013;16:313-7.
26. Doughari JH. Phytochemicals: Extraction methods, basic structures and mode of action as potential chemotherapeutic agents: INTECH Open Access Publisher; 2012.
27. Mamta S, Jyoti S, Rajeev N, Dharmendra S, Abhishek G. Phytochemistry of Medicinal Plants. Journal of Pharmacognosy and Phytochemistry. 2013;1(6):168-82.
28. Cardona Maya W. Current definition and treatment of premature ejaculation. Archivos Españoles de Urología. 2009;63(1):53-5.
29. Bahmanpour S, Talaei T, Vojdani Z, Panjehshahin MR, Poostpasand M, et al. Effect of Phoenix dactylifera Pollen on Sperm Parameters and Reproductive system of Adult Male Rats. Iranian Journal of Medical Sciences. 2006;31(4):208-12.
30. Vyawahare N, Pujari R, Khsirsagar A, Ingawale D, Patil M, Kagathara V. Phoenix dactylifera: An update of its indegenous uses, phytochemistry and pharmacology. The Internet Journal of Pharmacology. 2009;7(1).
31. Kuskoski EM, Roseane F, Garcia A, Troncoso GAM. Propiedades químicas y farmacológicas del fruto guaraná (Paullinia cupana). Vitae. 2005;12(2):45-52.
32. Tournaye H, Janssens R, Steirteghem A. The influence of pentoxifylline on motility and viability of spermatozoa from normozoospermic semen samples. International journal of andrology. 1994;17(1):1-8.
33. Lefievre L, Lamirande E, Gagnon C. The cyclic GMP‐specific phosphodiesterase inhibitor, Sildenafil, stimulates human sperm motility and capacitation but not acrosome reaction. Journal of Andrology. 2000;21(6):929-37.
34. Aitken R, Best F, Richardson D, Schats R, Simm G. Influence of caffeine on movement characteristics, fertilizing capacity and ability to penetrate cervical mucus of human spermatozoa. Journal of Reproduction and Fertility. 1983;67(1):19-27.
35. Serrano H, Garcia-Suarez M. Sperm aggregation by water extracts from two Bursera species. Systems Biology in Reproductive Medicine. 2001;46(1):15-20.
36. Mladenov I, Bulanov I, Stamenova M. The sperm-agglutinating activity of the fractions of saline root extracts from Arum maculatum. Eksperimentalna meditsina i morfologiia. 1992;31(1-2):22-8 [resumen].
Recibido: 8 de
septiembre de 2015.
Aprobado: 23 de
marzo de 2018.
Walter D. Cardona
Maya. Grupo Reproducción, Facultad de Medicina, Universidad de Antioquia.
Medellín, Colombia.
Correo electrónico.:
wdario.cardona@udea.edu.co