ARTÍCULO ORIGINAL
Farmacovigilancia de fitofármacos y apifármacos en Cuba durante 2006-2010
Pharmacovigilance of phytomedicines and apimedicines in Cuba, 2006-2010
Dra. Ana Karelia Ruiz Salvador,I Dra. Ana Julia García Milián,II Dra. Giset Jiménez López,III Dra. Ismary Alfonso Orta,III Dr. Bárbaro Pérez Hernández,I Dr. Armando Carrazana LeeI
I Facultad de Ciencias Médicas "General
Calixto García". La Habana, Cuba.
II Escuela Nacional de Salud Pública. La Habana, Cuba.
III Ministerio de Salud Pública. La Habana, Cuba.
Introducción: las plantas
y los productos de la colmena han sido una importante fuente de medicinas durante
un largo período, pero también pueden provocar reacciones adversas.
Objetivo: caracterizar las reacciones adversas asociadas al uso de los fitofármacos
y apifármacos que se comercializaron en Cuba en el período 2006-2010.
Método: se realizó un estudio observacional, descriptivo y
transversal. La muestra estuvo constituida por la totalidad de los reportes
de sospechas de reacciones adversas a medicamentos, producidas por fitofármacos
y apifármacos a la Unidad Coordinadora Nacional de Farmacovigilancia,
durante el período de estudio.
Resultados: la mayoría de los reportes de sospechas de reacciones
adversas se distribuyeron en el sexo femenino (73,3 %) y en el grupo etario
de 31 a 60 años (52,5 %). El ajo tintura y jarabe (13,4 %), el Vimang®
tableta y jarabe (9,7 %), así como el eucalipto jarabe y tintura (6,6
%) resultaron los fitofármacos más notificados, mientras que el
propóleos tintura (3,4 %) lo fue dentro de los apifármacos reportados.
El sistema digestivo resultó el más afectado por las reacciones
adversas, clasificadas mayormente de leves y probables.
Conclusiones: la farmacovigilancia realizada a los fitofármacos y
apifármacos en el período estudiado guarda relación con
lo reportado en la literatura para estos productos.
Palabras clave: farmacovigilancia, fitofármaco, apifármaco.
Introduction: plants and beehive products
have been an important source of medicines for a long time, but they may also
cause adverse reactions.
Objective: characterize the adverse reactions associated with the use of
phytomedicines and apimedicines sold in Cuba from 2006 to 2010.
Method: a cross-sectional observational descriptive study was conducted.
The sample consisted of all the reports on suspected adverse drug reactions
caused by phytomedicines and apimedicines submitted to the National Pharmacovigilance
Coordinating Unit during the study period.
Results: most reports on suspected adverse reactions corresponded to the
female sex (73.3 %) and the 31-60 age group (52.5 %). The phytomedicines most
frequently reported were garlic tincture and syrup (13.4 %), Vimang™
pills and syrup (9.7 %), and eucalyptus syrup and tincture (6.6 %), whereas
the most frequently reported apimedicine was propolis tincture (3.4 %). The
digestive system was the most commonly affected by adverse reactions, which
were mostly classified as mild or probable.
Conclusions: pharmacovigilance of phytomedicines and apimedicines during
the study period is consistent with the bibliographic information about the
topic.
Key words: pharmacovigilance, phytomedicine, apimedicine.
INTRODUCCIÓN
Las plantas y los productos de la colmena han sido durante un largo tiempo, una importante fuente de medicinas. En términos generales, la medicina natural funciona de la misma manera que los productos farmacéuticos convencionales, o sea por su composición química. Estos contienen muchos compuestos químicos que se dan por sí solos en la naturaleza y tienen actividad biológica.1 En los últimos 150 años los químicos y farmacólogos se han dedicado a aislar y purificar los componentes "activos" de estos compuestos, en un intento por producir nuevos fármacos.
Los ejemplos incluyen los fármacos como la digoxina, un digital derivado de la Digitalis purpurea; la reserpina de la Rauwolfia serpentina; la morfina del Papaver somníferum, entre otros.2
Los productos medicinales naturales se pueden utilizar para un sinfín de padecimientos considerados menores, que se prestan para la automedicación e incluyen trastornos estomacales, el resfriado común, la gripe, los dolores y las molestias leves de causa variada, la diarrea, la tos, erupciones, y otros.3
Hoy día no existe duda sobre la importancia de las plantas y de los productos de la colmena, como por ejemplo la miel y el propóleos, y a pesar del desarrollo alcanzado por la síntesis química, estos constituyen un arsenal de sustancias biológicamente activas. Esta afirmación hace, en ocasiones, que los seguidores de esa práctica la recomienden como segura e inocua. Sin embargo, el uso de los productos naturales en la terapéutica, requiere al igual que los productos sintéticos, de profundas investigaciones que no se limitan al campo de la experimentación, sino que una vez que se comercializan se siguen observando.4,5
Las reacciones adversas producidas por los fármacos son muy complejas y, con frecuencia, difícilmente valorables por la cantidad de factores que intervienen en su producción, modo de aparición, duración y gravedad. En efecto, pueden: a) aparecer inmediatamente después de iniciado el tratamiento, a lo largo de la administración o después de suspendida la medicación; b) ser muy frecuentes o poco frecuentes; c) ser evitadas mediante un ajuste fino de la dosis o ser inseparables de la acción terapéutica; d) ser expresión de una dosis terapéutica o aparecer solo con dosis supra terapéuticas, por sobredosificación, y e) ser triviales, graves o incluso mortales.6 Este planteamiento, referido para los medicamentos de síntesis químicas no está muy lejano de lo que sucede con los compuestos medicinales naturales, por lo que su control y seguimiento por parte de las autoridades sanitarias es de vital importancia.
La incidencia de reacciones adversas medicamentosas (RAM) por cualquier producto farmacéutico, encontrada en diversos estudios, varía entre 1 y 30 %, como resultado de las diferentes metodologías empleadas para detectar y evaluar estas reacciones, los estilos diferentes de prescripción de medicamentos y la inclusión o exclusión de las reacciones leves. Sin embargo, la mayoría de los estudios prospectivos muestran que la incidencia de RAM en los pacientes hospitalizados (excluidos los pacientes con reacciones leves) es entre 10 y 20 %.7
Los reportes epidemiológicos relacionados con las reacciones adversas medicamentosas informan de la extraordinaria importancia de esta temática, por solo citar algunos datos, cada año 2,2 millones de pacientes hospitalizados sufren una reacción adversa grave, estas constituyen entre la cuarta y sexta causa de muerte en los EE. UU. Además, las admisiones hospitalarias debido a reacciones adversas ocupan más de 10 % en algunos países, que destinan más de 20 % del presupuesto de salud en complicaciones producidas por fármacos. Todo esto ha provocado que desde 1995 el costo asociado a los problemas relacionados con los medicamentos se haya duplicado.7
Este comportamiento no es exclusivo de los productos farmacéuticos de síntesis química, los naturales también presentan problemas con su uso y estos varían de un país o zona a otra. Así por ejemplo, en China hace unos años se identificó la nefrotoxicidad grave e irreversible causada por algunas plantas medicinales (género Aristolochia) de uso tradicional en ese país, pero también en Europa, donde han sido responsables de un considerable número de casos de insuficiencia renal terminal.8,9
Este estudio se decide realizar por el espacio que ocupan en la terapéutica farmacológica actual en Cuba, su amplia utilización en los distintos servicios de atención médica que se presta, la repercusión social que tiene el uso de los medicamentos herbolarios y las consecuencias económicas y sanitarias de las reacciones que estos provocan. Todo lo anterior se corrobora si se tienen en cuenta que existe gran número de usuarios de medicamentos herbarios, pero se dispone de escasa información fiable acerca de su inocuidad. A eso se le adiciona que las notificaciones de sospechas de reacciones adversas para estos productos son bajas e insuficientes para detectar efectos adversos no reportados o importantes. Además, los consumidores tienden a utilizar esos productos para la automedicación, a veces junto a otros fármacos, porque tienen la opinión de que son inocuos, sin tener en cuenta las posibles interacciones medicamentosas a las que se exponen.
Todos estos elementos justifican la necesidad de realizar este estudio, de tal forma que permita disponer de valiosos elementos para hacer un uso racional de los fitofármacos y apifármacos, que mejore la efectividad de estos. En consecuencia se disminuirán los costos sanitarios y no sanitarios derivados del uso inadecuado de estos productos, al caracterizar las reacciones adversas asociadas al uso de los fitofármacos y apifármacos que se comercializan en el país, en el período 2006-2010.
MÉTODOS
Se trata de un estudio que clasifica como observacional, descriptivo y retrospectivo. Se consideró elegible para el mismo la totalidad de los reporte de sospechas de reacciones adversas medicamentosas producidas por fitofármacos y apifármacos a la Unidad Coordinadora Nacional de Farmacovigilancia (UCNFv) de Cuba ubicada en la Dirección Nacional de Medicamentos del Ministerio de Salud Pública durante los años 2006-2010.
Se incluyeron variables demográficas (edad, sexo), tipo de apifármaco y fitofármaco y de reacciones adversas medicamentosas. Las sospechas de RAM fueron clasificadas según el órgano afectado, la severidad y la causalidad. La información se obtuvo de la base de datos nacional (VIGIBASE) del Sistema Cubano de Farmacovigilancia. A partir de esta se confeccionó una nueva base de datos en Excel, que incluyó todas las reacciones adversas por fitofármacos y apifármacos reportadas durante el período de estudio.
Para clasificar las reacciones adversas aplicando relación de causalidad, gravedad y sistema de órgano afectado, se creó un grupo de 7 expertos farmacólogos y especialistas de Medicina General Integral con experiencia en el tema por más de 5 años. De ellos 3 pertenece al Hospital Docente Clínico Quirúrgico "General Calixto García", 2 a la UCNFv y 1 al CENCEC. Para la relación de causalidad, así como el sistema de órganos afectados se clasificó según los criterios de Uppsala Monitoring Center y la severidad siguiendo los criterios de Karch y Lasagna.10
Para el análisis de los datos se utilizó la estadística descriptiva. Como medidas de resumen se mostraron los datos en frecuencias relativas y absolutas. Los resultados se procesaron por el paquete estadístico Excel de Microsoft Office y se presentaron en tablas para una mejor comprensión. Desde el punto de vista ético, la investigación tuvo como objetivo esencial el aspecto puramente científico, sin afectaciones del medio ambiente ni riesgos predecibles, y se contó con el consentimiento informado del especialista que atiende las series de RAM de medicamentos de la UCNFv.
RESULTADOS
Durante el período analizado se recibieron en la Unidad Coordinadora Nacional de Farmacovigilancia, 640 notificaciones de sospechas de reacciones adversas producidas por el consumo de fitofármacos y apifármacos en el país.
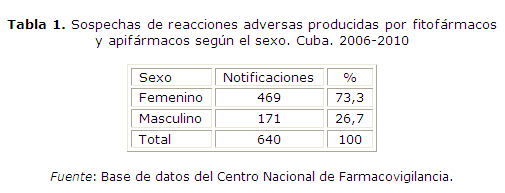
En la tabla 1 se muestra la distribución de las sospechas de reacción adversa según el sexo, producida por los fitofármacos y apifármacos en el período analizado, siendo el sexo femenino el más relacionado con sospechas de efectos adversos (469 notificaciones, 73,3 %).
Las notificaciones de pacientes adultos (tabla 2), constituyeron más de la mitad (64,2 %) de los reportes analizados, mientras que la edad pediátrica solo significó 2,2 % del total y cabe señalar que los pacientes mayores de 60 años representaron la tercera parte (33,6 %) de la notificaciones realizadas.
En la tabla 3 se observan las reacciones adversas más reportadas a los fitofármacos y apifármacos analizados. El ajo (Allium sativum L.) en tintura y jarabe, el Vimang® (Mangifera indica L.) en tableta y jarabe y el eucalipto (Eucalyptus spp.) en jarabe y tintura, fueron los responsables del mayor número de notificaciones (13,4; 9,7 y 6,6 %, respectivamente). La epigastralgia, los vómitos y las náuseas fueron las reacciones observadas para la mayoría de los medicamentos; cabe señalar que la hipotensión constituyó la principal reacción adversa reportada por el Vimang® (Mangifera indica L.), la sábila (Aloe vera L.) y la naranja agria (Citrus aurantium L.).
El sistema de órganos más afectado en los fitofármacos y apifármacos más notificados, resultó el digestivo, constituyendo más de la mitad de los reportes en cada caso, exceptuando la sábila (Aloe vera L.) y el Vimang® (Mangifera indica L.) que representó casi la tercera parte (tabla 4).
Tabla 4. Sospechas de reacciones
adversas según sistema de órgano afectado, en los fitofármacos y apifármacos
más notificados. Cuba. 2006-2010
|
Fitofármaco/apifármaco |
Sistema de órgano afectado |
|||||||||||
|
Piel |
Digestivo |
Nervioso central |
Cardiovascular |
Respiratorio |
General |
|||||||
|
No. |
% |
No. |
% |
No. |
% |
No. |
% |
No. |
% |
No. |
% |
|
|
Allium sativum L. (ajo tintura y jarabe) |
2 |
2,3 |
62 |
72,1 |
0 |
0 |
9 |
10,5 |
1 |
1,2 |
1 |
1,2 |
|
Mangifera indica L. (Vimang® tableta y jarabe) |
11 |
17,7 |
14 |
22,6 |
8 |
12,9 |
20 |
32,3 |
2 |
3,2 |
1 |
1,6 |
|
Eucalyptus spp. (eucalipto jarabe y tintura) |
5 |
11,9 |
20 |
47,6 |
1 |
2,4 |
5 |
11,9 |
7 |
16,6 |
1 |
2,4 |
|
Aloe vera L. (sábila jarabe) |
3 |
7,3 |
3 |
7,3 |
4 |
9,8 |
24 |
58,5 |
0 |
0 |
1 |
2,4 |
|
Cymbopogon citratus (DC.) (caña santa tintura) |
2 |
5,3 |
17 |
44,7 |
1 |
2,6 |
13 |
34,2 |
1 |
2,6 |
1 |
2,6 |
|
Psidium guajava L. (guayaba tintura) |
5 |
15,6 |
21 |
65,6 |
0 |
0 |
3 |
9,4 |
1 |
3,1 |
0 |
0 |
|
Citrus aurantium L. (naranja agria tintura) |
1 |
4,5 |
18 |
81,8 |
1 |
4,5 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Propóleo (propóleo tintura) |
3 |
13,6 |
12 |
54,5 |
2 |
9,1 |
1 |
4,5 |
1 |
4,5 |
1 |
4,5 |
|
Passiflora incarnata L. (pasiflora tintura) |
5 |
29,4 |
4 |
23,5 |
4 |
23,5 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Hipolip tintura (Allium sativum L. tintura y miel de abeja) |
0 |
0 |
17 |
100 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
En el estudio, la mayoría de las reacciones reportadas se clasificaron de leves y no se observaron reportes letales (tabla 5). Los 10 primeros fitofármacos causantes de la mayoría de las notificaciones, provocaron reacciones adversas leves o moderadas. El Vimang® (Mangifera indica L.), la sábila (Aloe vera L.) y la caña santa (Cymbopogon citratus [DC] Stapf.) fueron las de mayor frecuencia de reporte de leves (80,6; 78,0 y 73,7 %, respectivamente), mientras que la naranja agria (Citrus aurantium L.) fue la responsable del mayor porcentaje de moderadas (63,6 %).
En la tabla 6 se observa que la naranja agria (Citrus aurantium L.) (90,9 %), el hipolip (Allium sativum L. tintura 20 % y miel de abeja) (88,2 %) y la caña santa (Cymbopogon citratus DC.) (78,9 %) fueron los productos de mayor frecuencia de causar la reacción adversa probable. El Vimang® (Mangifera indica L.) resultó el responsable del porcentaje mayor de las reacciones consideradas condicionales. Solo se consideró una reacción no relacionada producida por el eucalipto (Eucalyptus spp.).
DISCUSIÓN
Los hallazgos que se muestran en la tabla 1 coinciden con los reportes realizados por la Unidad Coordinadora Nacional de Farmacovigilancia para el resto de los medicamentos11 y con otro estudio realizado por la autora en los años 2003 y 2007.12 De igual forma, una caracterización de las reacciones adversas a medicamentos identificadas en los servicios de emergencia en Corrientes, Argentina,13 señaló un mayor número de reacciones adversas medicamentosas en las mujeres con respecto a los hombres.
Esto pudiera estar influido entre otros factores, porque son las mujeres las mayores consumidoras de fármacos; acuden a los servicios de salud con más frecuencia que los hombres y en consecuencia, consumen fármacos en mayor proporción, bien por ser superior la probabilidad de detección y diagnóstico o por una elevada prescripción inducida por ellas mismas.14
Estudios recientes refieren que las féminas acuden con frecuencia al uso de la medicina herbolaria como alternativa para el tratamiento de síntomas propios del proceso de envejecimiento, la menopausia y el cáncer de mama.15,16
La mayor frecuencia de reacciones adversas identificadas en el grupo de 31 a 60 años de edad (tabla 2), difiere de la mayoría de lo reportado por la literatura, en la cual el anciano es con el que aparece un mayor número de reportes de reacciones adversas a los medicamentos.17
Esto pudiera deberse a que generalmente utilizan un alto número de medicamentos que pudieran provocar interacciones y además favorecer el incumplimiento, a lo que se añaden cambios fisiológicos que generan modificaciones de los procesos farmacocinéticos, como la disminución del metabolismo y de la excreción de los medicamentos. Lo antes dicho, trae como consecuencia que tiendan a aumentar los niveles séricos de esos medicamentos y por consiguiente una menor capacidad de compensación de los efectos farmacológicos.18
En estudios de farmacovigilancia en hospitales se ha establecido una relación lineal entre la edad y la frecuencia de reacciones adversas a medicamentos, que resultan muy bajas en personas entre 20 y 29 años y aumenta a un cuarto en adultos mayores.19 No obstante, según Low Dog, la población con edades comprendidas entre los 50 y 59 años tiende a aumentar el consumo de fitofármacos y, por consiguiente, un incremento de las reacciones adversas producidas por estos.20
En cuanto a la notificación de reacciones adversas por fitofármacos (tabla 3), se encontró coincidencia de reporte en este grupo etario con lo referenciado por Ávila.21 Un estudio realizado en población pediátrica reportó muy baja frecuencia de aparición de reacciones adveras en este grupo de edad,22 como se encontró en este trabajo. Este comportamiento pudiera explicarse por las escasas evidencias científicas que avalan el uso de esta alternativa en la terapéutica de menores. Por otra parte, las estrategias de educación a la población que desarrolla el Ministerio de Salud Pública con los medios de comunicación, sobre los riesgos de medicar a los menores sin previa prescripción médica, también pudiera explicar la baja frecuencia de aparición de reacciones adversas en este grupo etario.
Comportamiento similar al encontrado aquí se observó en un estudio realizado en China,23 que describe las reacciones adversas producidas por el consumo de sus medicamentos herbolarios y donde las manifestaciones más frecuentes fueron las náuseas, diarreas y vómitos.
La mayor frecuencia de reportes asociados a medicamentos herbolarios derivados del ajo, el aloe, la naranja y el propóleos, pudieran responder a la alta prevalencia en Cuba, de enfermedades en las que son utilizadas con más frecuencia estos productos24-27 (artropatías y dolencias del aparato respiratorio), por lo que los autores suponen un mayor uso de estos medicamentos.
En un metaanálisis28 realizado sobre el uso del Aloe vera (sábila) para el tratamiento de las quemaduras, se concluyó que este es muy consumido por la población y tiene una alta efectividad para esta afección; elementos estos que pudieran ayudar a explicar el número elevado de sospechas de reacciones adversas a ese producto encontradas en este estudio. Por otra parte, las preparaciones de ajo y sábila pueden ser elaboradas en el hogar, elemento condicionante para que su consumo sea más frecuente.
Las manifestaciones cutáneas reportadas para la sábila coinciden con las descritas por Ferreira29 en un estudio realizado en Portugal, donde la dermatitis por este producto resultó el hallazgo más frecuente. Este tipo de lesión, según Reider30 pudiera explicarse porque esta planta contiene sustancias tóxicas e irritantes, que son eliminadas en el proceso de producción industrial de formas farmacéuticas de uso tópico.
Aunque en la literatura31 existen reportes frecuentes de efectos hepatotóxicos para el ajo, la sábila y la valeriana, como consecuencia de los altos contenidos de alcaloides pirrolizidínicos en estas plantas, en el presente estudio el reporte de esta reacción fue muy bajo.
La presencia de mayor número de sospechas de reacciones adversas medicamentosas en el aparato digestivo (tabla 4), se explica porque dentro de las vías de administración que existen32 para los productos naturales, la oral es la más utilizada por la población y dentro de esta la forma farmacéutica más empleada es la tintura.33
Esta presentación tiene como excipiente el alcohol etílico, elemento que pudiera explicar, en parte, la aparición de ese tipo de reacciones, porque se conoce que produce afección de la mucosa gástrica, con daño del endotelio microvascular que conduce al lesión microvascular, cesación del suministro de oxígeno, del transporte de nutrientes y de ahí a una necrosis por isquemia.34
Contrario a lo que muchas personas piensan sobre la seguridad de los productos naturales, o sea, que estos son completamente seguros e inocuos, estos sí producen reacciones adversas y aunque en este estudio solo se reportó una reacción adversa grave, hay un considerable número de reacciones moderadas. La reacción adversa grave correspondió a 2007, en el cual hubo un reporte de reacción en un lactante de 2 meses, que se le administró anís estrellado de producción institucional para los cólicos abdominales y presentó coma.
Estos hallazgos constituyen una alerta para la población que consume productos naturales por automedicación, para el profesional de la salud en el momento del acto de la prescripción y para el farmacéutico durante el proceso de dispensación, donde se debe advertir al paciente de los riesgos a que están sometidos cuando emplean estos productos.
Estos resultados coinciden con estudios realizados por la autora donde se comparó el comportamiento de las reacciones adversas por fitofármacos en los años 2003, 2005 y 2007.35
A diferencia de lo reportado por la literatura, donde se plantea que las RAM clasificadas como posibles son los más frecuentes,36,37 en el presente estudio (tabla 6) el mayor número de reacciones adversas fueron incluidas dentro de la categoría de probable. Estos resultados coinciden con los encontrados por Santos Muñoz38 en Matanzas en un estudio similar en un período de 5 años.
Se concluye que la farmacovigilancia realizada a los fitofármacos y apifármacos en el período estudiado, guarda relación con lo reportado en la literatura para estos productos. La caracterización de las sospechas de reacciones adversas realizada a estos productos muestra similitud con la reportada a los medicamentos de síntesis química.
REFERENCIAS BIBLIOGRÁFICAS
1. Chaves L. Fitomedicina pasado y presente. Boletín Fármaco. 2010. [citado Nov 2012]. Disponible en: http://www.farmeco.com.uy/fitomedicina-pasado-y-presente/homeopatia
2. Morón F. Plantas medicinales y medicamentos herbarios. En: Farmacología general. La Habana: Editorial ECIMED; 2002. p. 195-205.
3. Melgarejo N, Álvarez G, Alonso A. Guía práctica para la prescripción fitoterapéutica en la Atención Primaria de Salud. Rev Cubana Med Gen Integr. [revista en la Internet]. 2004 Abr [citado 2012 Nov 30]; 20(2). Disponible en: http://scielo.sld.cu/scielo.php?pid=S0864-21252004000200009&script=sci_arttext
4. González M, Remirez D, Jacobo OL. Antecedentes y situación reguladora de la medicina herbaria en Cuba. Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas. 2007;6(4):118-24.
5. Tamayo C. Fitoterapia basada en la evidencia. Revista de Fitoterapia. 2006[citado Nov 2012];6(S1):55-60. Disponible en: http://www.plantas-medicinais.com/revista/pdf/C-TAMAYO.pdf
6. Normas y Procedimientos del Sistema Cubano de Farmacovigilancia; 2007 [serie en Internet]. [citado Ene 2012]. Disponible en: http://www.cdf.sld.cu/farmacovigilancia
7. Alfonso Orta I, Jiménez López G, Ávila Pérez J, Chao Cardeso A. Comportamiento de las reacciones adversas a medicamentos en Cuba. Año 2007. Rev Electron Biomed. 2009[citado Dic 2012];2:20-9. Disponible en: http://biomed.uninet.edu/2009/n2/alfonso.html
8. World Health Organization. WHO Guidelines on safety monitoring of herbal medicines in pharmacovigilance systems. Geneva WHO; 2004 [citado Nov 2012]. Disponible en: http://www.who.int/patientsafety/events/05/Reporting_Guidelines.pdf
9. Zhu Y-P. Toxicity of the Chinese herb mu tong (Aristolochia manshuriensis): What history tells us. Adverse Drug Reactions & Toxicological Reviews (now known as Toxicological Reviews). 2002;21(4):171-7.
10. Naranjo C, Usoa EB. Reacciones adversas a medicamentos. En: Métodos de farmacovigilancia clínica. Programa Desarrollo de Servicios de Salud. Organización Panamericana de la Salud. Washington DC.: Oficina Sanitaria Regional de la Organización Mundial de la Salud; 1992. p. 331.
11. Jiménez G, Debesa F, González B, Ávila J, Pérez J. El Sistema Cubano de Farmacovigilancia, seis años de experiencia en la detección de efectos adversos. Rev Cubana Farm [serial en Internet].2006;40(1): Disponible en: http://bvs.sld.cu/revistas/far/vol40_1_06/far02106.htm
12. García AJ, Ávila J, Alonso L, López P, Ruiz AK, Morón FJ. Reacciones adversas reportadas por consumo de productos naturales en Cuba durante 2003 y 2007. Rev Cubana Plant Med [revista en la Internet]. 2009 Mar [citado 2012 Nov];14(1). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1028-47962009000100002
13. Carrara C, Cuper P, Gonseski P, Rolli V, Morales S, Valsecia M. Reacciones adversas a medicamentos en los servicios de emergencia hospitalarios de la ciudad de Corrientes; 2004. Disponible en: http://www.unne.edu.ar/Web/cyt/com2004/3-Medicina/M-089.pdf
14. Kotouckova M, Majtas J, Springer V. Studies of sex as a factor in drug consumption. Pharmazie. 2002;47:144-6.
15. Borrelli F, Ernst E. Black cohosh (Cimicifuga racemosa): a systemic review of adverse events. Am J Obstet Gynecol. 2008;199:455-66.
16. Roberts H. Safety of herbal medicinal products in women with breast cáncer. Maturitas. 2010;66:363-9.
17. Patiño B, López M, Villares P, Jiménez A. El paciente anciano polimedicado: efectos sobre su salud y sobre el sistema sanitario. Información Terapéutica del Sistema Nacional de Salud [serial en la Internet]. 2005;29(6): Disponible en: http://www.msc.es/biblioPublic/publicaciones/docs/vol29_6AncianoPolimedicado.pdf
18. Rodríguez R, Jiménez G, Fernández E, González B. Caracterización de las reacciones adversas medicamentosas en ancianos. Cuba, 2003-2005. Rev Cubana Farm [serial on the Internet]. 2007 41(3): [citado 2010]. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75152007000300002&lng=es&nrm=iso
19. Castillo Y, Valenzuela E. Fármacos en el adulto mayor; 2005 [citado Ene 2011]. Disponible en: http://escuela.med.puc.cl/paginas/publicaciones/TemasMedicinaInterna/farmacos.html
20. Dog TL. Assessing safety of herbal products for menopausal complaints: An international perspective. Maturitas. 2010;66:355-62.
21. Ávila J. Reacciones adversas a medicamentos herbarios y otras formas de medicina natural y tradicional en Cuba durante 2001-2004. Rev Cubana Plant Med [revista en la Internet]. 2008 [citado 2012 Nov];13(1). Disponible en: http://bvs.sld.cu/revistas
22. Hernández A, Jiménez G, Peña MA, Fernández E, Notario M. Vigilancia de efectos adversos provocados por medicamentos y técnicas de medicina natural en la población pediátrica. Rev Cubana Farm [revista en la Internet]. 2007 Dic [citado 2012 Ene 23];41(3): Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75152007000300006&lng=es
23. Mac Pherson H, Liu B. The safety of Chinese herbal medicine: A pilot study for a national survey. J Alternative Complementary Med. 2005;11 (4):617-26.
24. Rodríguez R. Asma. Rev Cubana Med Gen Integr. 1992;8(3):259-60.
25. Roudaut M, Meda A, Fadiga D. Prevalence of asthma and respiratory diseases in schools in Bouaké (Ivory Coast), preliminary results. Med Trop Mars. 1992;52(2):279-83.
26. Boletín de Información Terapéutica para Atención Primaria de Salud. Nov-Dic;1996. Boletín No. 2.
27. TRAMIL. Farmacopea vegetal caribeña. Enda/caribe. 2004;36(54):258.
28. Maenthaisong R, Chaiyakunapruk N, Niruntraporn S, Kongkaew C. The efficacy of aloe vera used for burn wound healing: A systematic review. Burns. 2007;(33):713-8.
29. Ferreira M, Teixeira M, Silva E, Selores M. Allergic contact dermatitis to Aloe vera. Contact Dermatitis. 2007;57:278-9.
30. Reider N, Issa A, Hawranek T, Schuster C, Aberer W, Kofler H, et al. Absence of contact sensitization to Aloe vera (L.) Burm. F. Contact Dermatitis. 2005;53:332-4.
31. Fernandes P, Medeiros MA. Farmacovigilância e reações adversas às plantas medicinais e fitoterápicos: uma realidade. Rev Bras Farmacogn. 2008;18(4).
32. Álvarez M. Vías de administración de los medicamentos y sus formas farmacéuticas. En: Farmacología General. La Habana: Editorial Ciencias Médicas; 2002. p. 22-33.
33. Alonso J. Aplicación de los Fitofármacos en la clínica diaria. En: Lozoya X. V Simposio Internacional de Fitofármacos: Los Fitofármacos en la Clínica Moderna. México DF: IMSS-Farmassa Schwabe; 2001. p. 79-88.
34. Tarnawski A. Mecanismos celulares y moleculares de la mucosa gástrica: La injuria a la mucosa y la acción protectora de los antiácidos. Rev Gastroenterol Perú. 1995;15(1):74-8 [citada Oct 2011]. Disponible en: http://sisbib.unmsm.edu.pe/bvrevistas/gastro/vol_15n1/mecanismos.htm
35. García AJ, Alonso L, Ávila Y, López P, Ruiz AK, Morón FJ. Reacciones adversas reportadas con el consumo de productos naturales en Cuba. 2003,2005, 2007. Lat Am J Pharm. 2009;28(3):337-43.
36. Anónimo. Registro de acontecimientos adversos en ensayos clínicos. Boletín de la Sociedad Española de Farmacología Clínica dirigido a los Comités Éticos de Investigación Clínica. ICB 11. Barcelona: Instituto Catalán de Farmacología; 1994 [citado 2008 May 19]. Disponible en: http://www.icf.uab.es/icbdigital/pdf/boletines/icb1194.pdf
37. Jiménez G, Debesa F, González B, Ávila J, Pérez J. El Sistema Cubano de Farmacovigilancia: seis años de experiencia en la detección de efectos adversos. Rev Cubana Farm. 2006;40(1) [citado 19 Sep 2009]. Disponible en: http://bvs.sld.cu/revistas/far/vol40_1_06/far02106.htm
38. Santos L, Perdomo J, González E. Comportamiento de las reacciones adversas reportadas por productos naturales: Matanzas 2003-2008. Rev Med Electrón Matanzas. 2009;31(6) [citado 23 Ene 2012]. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1684-18242009000600001&lng=es&nrm=iso
Recibido: 6 de febrero de 2012.
Aprobado: 30 de diciembre de 2012.
Ana Karelia Ruiz Salvador. Facultad de Ciencias Médicas "General Calixto García". Universidad e/ J y G, Vedado. La Habana, Cuba. Correo electrónico: karelia.ruiz@infomed.sld.cu