ARTÍCULO ORIGINAL
Potencial de actividad antioxidante de extractos fenólicos de Theobroma cacao L. (cacao)
Antioxidant potential of phenolic extracts of Theobroma cacao L. (cocoa)
MSc. Janet Quiñones Gálvez, Dr. C. Reinaldo Trujillo Sánchez, MSc. Yanelis Capdesuñer Ruiz, Téc. Yemeys Quirós Molina, Dra. C. Martha Hernández de la Torre
Centro de Bioplantas. Laboratorio Ingeniería Metabólica. Universidad de Ciego de Ávila, Cuba.
Introducción: Theobroma cacao
L. (cacao), familia Sterculiaceae, es una planta rica en fenoles, los cuales
en las plantas son de especial interés por su potente actividad antioxidante,
dada esencialmente por sus propiedades redox, que pueden desempeñar un
papel importante en la absorción y neutralización de los radicales
libres.
Objetivos: seleccionar un clon promisorio en la producción de compuestos
fenólicos, determinar los órganos con mayor contenido de fenoles,
establecer el cultivo in vitro a partir de la evaluación del tipo
de explante y determinar el contenido de fenoles, así como la potencial
actividad antioxidante de extractos de callos y órganos en Theobroma
cacao.
Métodos: nucelas, pétalos y estaminoides se cultivaron en
medio de formación de callos y se midió su crecimiento. Se cuantificó
el contenido de fenoles de extractos de hojas, ramas, semillas, flores y raíces,
así como de callos de estaminoides, pétalos y nucelas. La actividad
antioxidante se determinó para niveles de malondialdehído y otros
aldehídos y por la actividad de reducción del radical 1,1-diphenyl-2-picrylhydrazyl.
Resultados: se encontró mayor contenido de fenoles en semillas de
UF-654. Con estaminoides y pétalos se obtuvo mayor crecimiento de callos
y menor fenolización. Menores concentraciones de malondialdehído
y otros aldehídos se hallaron en extractos de ramas. Los extractos de
callos de estaminoides, pétalos y nucelas mostraron similares valores
de malondialdehído, mientras que en el caso de otros aldehídos
los menores valores se encontraron en los extractos de callos de nucelas. Todos
los extractos mostraron actividad antioxidante, que reducen el 1,1-diphenyl-2-picrylhydrazyl.
Se halló menor actividad en los extractos de ramas, callos de estaminoides
y nucelas.
Conclusiones: estos resultados proporcionan una información básica
prometedora para el uso potencial de extractos metanólicos y acuosos
de T. cacao L. como antioxidante.
Palabras clave: cacao, compuestos fenólicos, actividad antioxidante.
Introduction: Theobroma cacao L.
(cocoa), family Sterculiaceae, is a plant rich in phenols. These substances
are especially interesting in plants, due to their powerful antioxidant activity,
essentially given by their redox properties, and may play an important role
in the absorption and neutralization of free radicals.
Objectives: select a promising clone from the production of phenolic compounds,
determine the organs with the greatest content of phenols, establish the in
vitro culture based on evaluation of the explant type, and determine the content
of phenols as well as the potential antioxidant activity of callus and organ
extracts of Theobroma cacao.
Methods: nucelli, petals and staminodes were cultured in a callus forming
medium and their growth was measured. Phenolic content was quantified in extracts
of leaves, branches, seeds, flowers and roots, as well as calluses of staminodes,
petals and nucelli. Antioxidant activity was determined for levels of malondialdehydes
and other aldehydes, and based on the reduction activity of the radical 1,1-diphenyl-2-picrylhydrazyl.
Results: a greater phenolic content was found in UF-654 seeds. Higher callus
growth and lower phenolization was obtained with staminodes and petals. Lower
concentrations of malondialdehydes and other aldehydes were found in extracts
from branches. Extracts from staminode, petal and nucellus calluses exhibited
values similar to malondialdehydes, whereas in other aldehydes the lowest values
were found in extracts from nucellus calluses. All extracts showed antioxidant
activity, reducing 1,1-diphenyl-2-picrylhydrazyl. Lower activity was found in
extracts from branches, staminode calluses and nucelli.
Conclusions: these results provide promising basic information for the potential
use of methanolic and aqueous extracts of Theobroma cacao L. as antioxidants.
Key words: cocoa, phenolic compounds, antioxidant activity.
INTRODUCCIÓN
Las plantas constituyen una fuente importante de diversidad natural por la multitud de compuestos que sintetizan y en la mayoría de los casos son útiles en el control de enfermedades en la agricultura, la medicina humana y en la preservación de alimentos.1,2 Varios de estos químicos son metabolitos secundarios que tienen funciones importantes en la interacción entre las plantas y el medio ambiente que las rodea, pueden ser atrayentes de insectos polinizadores y actuar en la defensa al ataque por microorganismos, otras plantas o animales.3
Los metabolitos secundarios en las plantas usualmente se clasifican por sus caminos biosintéticos en tres grandes grupos: fenoles, terpenos y esteroides, y alcaloides.4 La mayoría de estos metabolitos de importancia farmacológica, dentro de los que se encuentran los compuestos fenólicos, se aíslan a partir de plantas, porque su síntesis química no es factible económicamente.5
La naturaleza de los compuestos fenólicos en plantas es compleja. Los fenoles se asocian con procesos de maduración de plantas y tejidos, mecanismos de defensa, y características importantes de productos alimenticios derivados de plantas.6 Los compuestos fenólicos en las plantas se destacan en la actualidad por ser atractivos en el campo de la nutrición, la salud y la medicina, debido a las evidencias de que pueden actuar como potentes antioxidantes, anticancerígenos, antifúngicos o modular rutas importantes in vivo en mamíferos.7
El cultivo de células y tejidos representa una alternativa biotecnológica para la producción de metabolitos secundarios, independiente de las condiciones ambientales.8 En los últimos años se ha incrementado el uso de estas técnicas para la producción de metabolitos secundarios a partir de plantas y existen diferentes estrategias para la producción de estos compuestos a partir del cultivo de células (callos y suspensiones celulares).9,10 Existen varios factores, como son el genotipo y tipo de explante, que afectan el desarrollo de los sistemas de células y tejidos, y que deben evaluarse para la producción de metabolitos a partir del cultivo in vitro de plantas.11
El cacao (Theobroma cacao L.), de la familia Sterculeaceae, es el material de partida para la producción de chocolate. Se conoce en medicina popular como antiséptico, diurético y antiparasitario.12 Algunos trabajos informan estudios realizados en el cultivo in vitro de cacao, a partir de diferentes tipos de explantes como nucelas, pétalos, estaminoides, entre otros.13-23 Sin embargo, el cacao es una especie recalcitrante y es necesario establecer la metodología de cultivo in vitro para cada genotipo.17,22,23
Hasta la fecha, no existen referencias sobre el estudio y la obtención de compuestos fenólicos a partir del manejo del cultivo in vitro de T. cacao. El presente trabajo estuvo encaminado a seleccionar un clon promisorio en la producción de compuestos fenólicos, así como seleccionar los órganos con mayor contenido de fenoles en este clon, establecer su cultivo in vitro a partir de la evaluación del tipo de explante y determinar el contenido de fenoles y actividad antioxidante de extractos de callos y órganos en Theobroma cacao L.
MÉTODOS
Los experimentos se desarrollaron en los Laboratorios de Células y Tejidos e Ingeniería Metabólica del Centro de Bioplantas, Ciego de Ávila, Cuba. Como material vegetal se utilizaron botones florales de 1 cm de longitud (pétalos y estaminoides) y frutos inmaduros (nucelas) de plantas adultas en condiciones de campo del clon UF-654 de Theobroma.cacao (L.) Vent. Cacao (Sterculiaceae), depositado en el herbario del Jardín Botánico de Cienfuegos, Cuba, con número de voucher AJBC 5887, para determinar el tipo de explante en el establecimiento del cultivo in vitro. La desinfección de los explantes se realizó con hipoclorito de sodio 1 % (m/v) por 20 min, se colocaron en medio de crecimiento de callos primarios por 14 días y posteriormente se colocaron en medio de crecimiento de callos secundarios hasta los 70 días, de acuerdo a Li y otros.13 La masa de los callos (mg) se determinó cada 14 días. Se utilizaron 45 explantes por tratamiento.
Los compuestos fenólicos de T. cacao L. se extrajeron y cuantificaron según Gurr y otros.24 Para ello se maceraron en nitrógeno líquido 0,1 g de cada material vegetal (semillas de los clones IMC-67, UF-12, UF-613, UF-650, UF-654, UF-668, UF-677) y hojas, flores, semillas, ramas, raíces de plantas de campo y callos formados in vitro a partir de estaminoides, nucelas y pétalos del clon UF-654 de T. cacao. La determinación de la concentración de fenoles se realizó con el reactivo Folin-Ciocalteu. La densidad óptica se midió a 725 nm. La curva patrón se estableció con ácido clorogénico. Se midieron un total de 9 observaciones
La determinación de una potencial actividad antioxidante de los extractos a través del ensayo de sustancias reactivas al ácido tiobarbitúrico (ATB): malondialdehído (MDA) y otros aldehídos (propanal, butanal, hexanal, heptanal y propanal-dimetilacetal) se realizó de acuerdo con Harding y Benson,25 así como Ait Barka y otros,26 respectivamente.
Para ello se maceraron en nitrógeno líquido 0,1 g de hojas, flores, semillas, ramas, raíces de plantas de campo y callos formados in vitro a partir de estaminoides, nucelas y pétalos del clon UF-654 de T. cacao. El máximo de absorción del complejo formado por ATB-MDA se leyó a 532 nm25 y se restó la absorción a 600 nm (turbidez no específica, sustancias no-MDA) y a 455 nm para los otros aldehídos.26 Para el cálculo de la concentración de MDA se utilizó un coeficiente de extinción de 155 mM-1.cm-1 y para los otros aldehídos de 45,7 mM-1.cm-1. Los resultados se expresaron en µM.g-1 de masa fresca. Se midieron un total de 9 observaciones.
Para determinar la actividad antioxidante, por la reducción del radical 1,1-diphenyl-2-picrylhydrazyl (DPPH), se evaluaron extractos fenólicos crudos de: raíces, ramas, semillas, flores, hojas de plantas de campo y callos formados in vitro a partir de estaminoides, nucelas y pétalos (1 mg de extracto en 1 mL de etanol) del clon UF-654 de T. cacao.
La actividad de reducción del DPPH se estimó de acuerdo con Hanato y otros27 El extracto fenólico seco se diluyó en etanol absoluto a diferentes concentraciones (de 0,5 a 500 µg.mL-1). La absorbancia se midió a 517 nm y se comparó con idénticas concentraciones de un patrón de quercetina. Para cada dilución del extracto, la actividad de reducción del radical DPPH se calculó como: ([A0-A1]/A0)*.100, donde A0 es la absorbancia del control y A1 es la absorbancia de la muestra. La actividad antirradical se expresó finalmente como CE50 (µg.mL-1), concentración de extracto requerido para causar 50 % de reducción. Un menor valor de CE50 se corresponde con una mayor actividad antioxidante del extracto fenólico. Todas las muestras se analizaron por triplicado.
El procesamiento estadístico de los resultados se realizó con el utilitario Statistical Package for Social Sciences (versión 11.5 para Windows, SPSS Inc.). En todos los casos se realizaron pruebas paramétricas: ANOVA simple, Tukey, p£ 0,05.
RESULTADOS
Al evaluar el contenido de fenoles totales de los extractos de semillas de 7 clones (IMC-67, UF-12, UF-613, UF-650, UF-654, UF-668 y UF-677) (datos no mostrados). Los extractos de semillas del clon UF-654 mostraron los mayores valores en contenido de compuestos fenólicos, expresados como equivalentes de ácido clorogénico, con respecto al resto de los clones evaluados. El comportamiento de los 7 clones es diferente, lo cual indica que el genotipo influye en el contenido de esos compuestos en T. cacao.
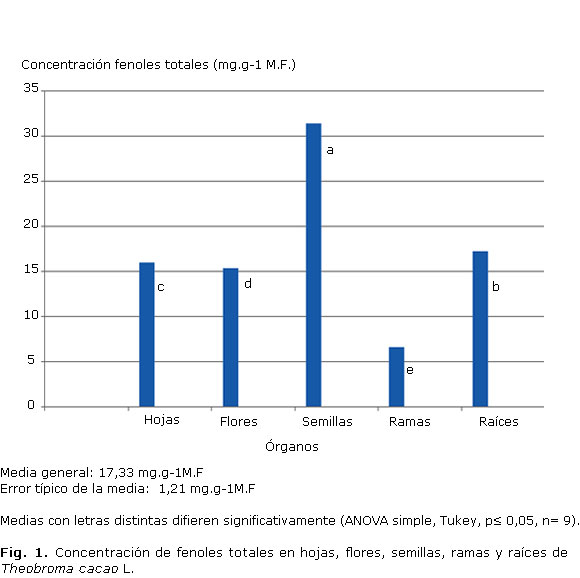
Determinar el contenido de fenoles totales en los diferentes órganos del clon UF-654 (Fig. 1) resulta de gran importancia para seleccionar el órgano a partir del cual se establecerá el cultivo in vitro.
La localización de metabolitos secundarios en el vegetal está muy relacionada con su actividad biológica y puede ser beneficiosa para las plantas. El tejido o la localización celular de compuestos del metabolismo secundario constituyen una poderosa herramienta para potenciar su actividad biológica. El conocimiento de la localización en la naturaleza permite diseñar procesos de extracción eficientes para utilizarlos en beneficio humano.
Los contenidos mayores de fenoles totales se encontraron para las semillas, seguidas por las raíces, hojas, flores y ramas consecutivamente. En sentido general, para el clon UF-654, las ramas resultaron las que contenían menores concentraciones de fenoles, comparados con el resto de los órganos evaluados, con diferencias significativas.
Una vez comprobado que el órgano de mayor contenido de fenoles era la semilla y que la flor se encontró entre los de menor concentración de estos compuestos, se procedió a comparar el establecimiento del cultivo in vitro, partiendo de explantes que procedían de esos órganos: estaminoides y pétalos (de botones florales) y nucelas (de semillas).
Durante los 14 días iniciales de cultivo en el medio de inducción de callos, los estaminoides y pétalos mostraron un aumento en tamaño y volumen para dar lugar a la formación de callos en diferentes grados de intensidad, que resultó mayor para el caso de los estaminoides (datos no mostrados).
Contrario a esto, las nucelas presentaron un menor desarrollo y la aparición de los callos no siempre se dio tras el aumento de volumen del explante. En la mayoría de los casos los explantes se necrosaron y fue a partir de este tejido, que posterior a los 14 días comenzó la formación de callos, que mantuvieron un menor crecimiento que en el caso de los estaminoides y pétalos durante todo el tiempo evaluado, excepto a los 28 días donde no mostraron diferencias con los pétalos.
El crecimiento de callos a partir de estaminoides se mantuvo por encima de los pétalos y nucelas hasta los 28 días, pero a partir de los 42 días no existieron diferencias entre estaminoides y pétalos. En el caso de estos últimos ocurre la formación de callos con muy poco necrosamiento o sin este, además, durante su crecimiento se encontraron diferentes tipos de callos que variaban en cuanto a su forma y coloración. La coloración varía en dependencia de las etapas, algunos adquieren una coloración más oscura y otros se tornan de coloración amarilla.
En la figura 2 se encuentran los valores del contenido de compuestos fenólicos en callos de estaminoides, pétalos y nucelas.
En la figura 3 se muestran los resultados del ensayo de sustancias reactivas al ácido tiobarbitúrico (malondialdehído (MDA) (Fig. 3A) y otros aldehídos (propanal, butanal, hexanal, heptanal y propanal-dimetilacetal) (Fig. 3B).
Las ramas resultaron los órganos con menores valores de MDA (Fig. 3A), el resto de los órganos se mantuvieron por encima y no mostraron diferencias entre sí. Para el caso de otros aldehídos (Fig. 3B), las ramas igualmente fueron el órgano de menor concentración, seguidas de hojas, flores y semillas; la mayor concentración la mostraron las raíces.
En los callos formados a partir de estaminoides, pétalos y nucelas de T. cacao (Fig. 4) el comportamiento se mostró similar para la concentración de malondialdehidos (Fig. 4A) en los 3 casos. Sin embargo, al analizar la concentración de otros aldehidos (Fig. 4B), los callos formados a partir de nucelas presentaron los menores valores.
Como se puede observar en la figura 5 para cada muestra se informa la CE50. Al comparar cada una, la muestra más activa resultó el extracto de raíces con la CE50 similar a la quercetina, flavonoide de reconocida actividad antioxidante. Otro extracto con actividad cercana a la quercetina fue el de hojas, seguido por el de callos de estaminoides, semillas y flores. Todos estos extractos requirieron menor concentración para reducir el mismo porcentaje de DPPH (50 %).
Los extractos fenólicos crudos mostraron actividad antioxidante, con los de menor actividad en los de ramas, callos de estaminoides y callos de nucelas. La magnitud de la actividad de reducción del radical DPPH depende del órgano de la planta (Fig. 5). Los valores de CE50 mostraron hasta 12 veces más actividad de los extractos de raíces (13,26 µg.mL-1) con respecto a los de ramas (154,55 µg.mL-1); 5 veces más que los de flores (68,51 µg.mL-1) y semillas (67,78 µg.mL-1); y 2 veces más que los de hojas (23,36 µg.mL-1).
El explante a partir del cual se formaron los callos también influyó sobre la actividad antioxidante de los extractos. Los extractos de los callos formados a partir de estaminoides mostraron mayor actividad (63,84 µg.mL-1), con 4 veces más actividad que los formados a partir de pétalos (259,90 µg.mL-1) y 2 veces más que los de nucelas (120,52 µg.mL-1).
DISCUSIÓN
Los clones evaluados tenían igual edad y estado de desarrollo por lo que las diferencias obtenidas deben estar relacionadas con el genotipo, o sea, con los diferentes clones. Zapata y otros28 obtuvieron resultados similares en plantas de girasol y tabaco, demostraron que la excreción de compuestos fenólicos depende del genotipo, la edad y el estado de desarrollo de la planta.
Los compuestos fenólicos se encuentran abundantemente en todas las partes de la planta, como son las ramas, los tallos, las hojas, los frutos, las raíces, las flores, el polen y las semillas.29 Existe diferencia en la capacidad de síntesis, acumulación y excreción de metabolitos fenólicos por las plantas. La cantidad de fenol producido depende del órgano de la planta y su estado de desarrollo, lo cual se pudo confirmar en las evaluaciones realizadas a los diferentes órganos de los clones.
La semilla es el órgano de donde se produce el chocolate, que es un alimento rico en compuestos fenoles, por lo que los resultados pueden estar relacionados con que la síntesis de estos compuestos se realiza tempranamente en las hojas, después se trasloca hacia sus diferentes funciones y se almacena una gran parte en la semilla. Las semillas de cacao son ricas en polifenoles, contribuyendo con 12 a 18 % de la masa seca de toda la semilla. Los polifenoles de las semillas de cacao se asocian ampliamente con el color y el sabor del chocolate.20
Zapata y otros28 observaron mayor acumulación de fenoles en la parte aérea que en la raíz, lo cual coincide totalmente con los resultados del presente trabajo, porque los mayores niveles de fenoles se encontraron en partes aéreas (semillas).
En la inducción de la embriogénesis somática de cacao, varios autores estudiaron la respuesta de explantes a la callogénesis, ya sea tanto en estaminoides y pétalos13,14-21,29 como en nucelas,12,15 los que obtuvieron diferentes resultados de acuerdo con la metodología utilizada y el tipo de explante. De igual modo, en el presente trabajo, a pesar que todos los explantes indujeron callogénesis, la respuesta varía en dependencia del tipo explante. Traore y Guiltinan30 obtuvieron resultados similares cuando la formación en callos a partir de estaminoides resultó mayor que en pétalos.
La capacidad embriogénica se asocia en ocasiones con una concentración balanceada de polifenoles. Altas concentraciones de amidas de ácido hidroxicinámico han sido asociadas con una respuesta no embriogénica en cacao, estos fenoles se relacionan más con el estrés que con un estado embriogénico.22
Los resultados para el clon UF-654 coinciden con los informados en la literatura1,22,30 para especies de este género y tiene gran importancia para desarrollar estrategias de producción de estos metabolitos a partir del cultivo in vitro de Theobroma cacao L. Los estaminoides y pétalos mostraron un mayor crecimiento de callos que las nucelas, estas últimas presentaron una gran fenolización durante la formación de callos.
Recientemente se ha prestado gran atención sobre el papel de los antioxidantes naturales, en particular los compuestos fenólicos, los cuales pueden actuar reduciendo el contenido de compuestos tóxicos en los alimentos o como suministro al cuerpo humano como antioxidantes exógenos.31 Las sustancias fenólicas poseen una alta actividad antioxidativa y se encuentran mayormente en los frutos y las hojas de los vegetales.30 Muchos de estos fenoles se clasifican en 2 grupos principales: los ácidos fenol carboxílicos y los flavonoides, estos últimos son los más significativos32 y derivados del flavan (2-fenil-benzoildihidropirano).
La capacidad antioxidante de los compuestos fenólicos se basa en su capacidad para donar átomos de hidrógeno a radicales libres. Muchos compuestos fenólicos, particularmente flavonoides, exhiben un amplio rango de efectos biológicos, incluido, antibacterial, antiviral, antiinflamatorio, antialérgico, antitrombótico y acción vasodilatadora.33 Estos estudios han demostrado que algunos de esos compuestos son potentes asimiladores de radicales libres y como tales, son útiles en la prevención de arterioesclerosis, cáncer, diabetes, enfermedades neurodegenerativas y artritis.
Se ha informado que los productos del rompimiento de las cadenas por la peroxidación lipídica de 3 átomos de carbono, malondialdehìdo (MDA) y otros fragmentos de aldehídos de cadenas largas y derivados a parir de los radicales peroxil (RO2.) o alcohoxil (RO.) son productos estables, los cuales reaccionan con el ácido tiobarbitúrico para formar productos colorimétricos. En el presente trabajo se expresa el contenido de malondialdehido (MDA) y otros aldehidos (OAD) en los extractos de los diferentes órganos y callos provenientes de la planta de Theobroma cacao L.
Lee y otros34 mostraron que el cacao tiene más fenólicos y una mayor capacidad antioxidante que el té y el vino tinto. Hasta la fecha, en T. cacao L., los estudios de compuestos fenólicos se enfocan mayormente en semillas fermentadas y su licor, dada la importancia en la industria del chocolate.
Los flavonoides de cacao tienen un amplio rango de propiedades biológicas como la modulación de la síntesis de eicosanoides, el incremento de la síntesis de óxido nítrico, la disminución de la razón de oxidación de lipoproteínas de baja densidad (LDL), la inhibición de la activación de las plaquetas, la estimulación de la producción de citoquinas anti-inflamatorias y la inhibición de la producción de algunas citoquinas pro-inflamatorias.35-37
Los compuestos antioxidantes pueden detener o inhibir la oxidación de los lípidos o de otras moléculas por la inhibición de la iniciación de la propagación de las reacciones de cambio de oxidación. La actividad antioxidante de los compuestos fenólicos se debe mayormente a sus propiedades redox, las cuales desempeñan un papel importante en la adsorción y neutralización de radicales libres.36
Para el caso de los tejidos de T. cacao evaluados, los extractos de ramas y flores mostraron los menores valores de los productos de la peroxidación lipídica (malondialdehído y otros aldehídos), lo cual podría estar relacionado con una mayor presencia de compuestos con actividad antioxidante, encargados de neutralizar los radicales libres originados durante estos procesos. Le siguen las hojas, semillas y raíces, mientras que los callos formados a partir de estaminoides, pétalos y nucelas mostraron similar comportamiento para el caso de malondialdehído. No resulta así en otros aldehídos, en los cuales las nucelas mostraron mayor actividad con menores valores.
Es de señalar que a pesar de ser el MDA el principal producto final de la peroxidación lipídica resultado de la oxidación de los ácidos grasos insaturados, fundamentalmente el linoleico, también se pueden formar otros aldehídos en mayor o menor medida, de acuerdo con los resultados obtenidos en esta y otras especies de plantas.38
Hasta la fecha se han desarrollado muchos métodos con el uso de la reducción de radicales para evaluar la actividad antioxidante.39 En este estudio, los ensayos DPPH y sustancias reactivas al ácido tiobarbitúrico se usaron para estimar los valores de actividad antioxidante de los extractos de material in vitro y ex vitro de T. cacao. Para los extractos de plantas ex vitro las actividades fueron órgano-dependiente, el ensayo DPPH reveló que se extrajo una considerable actividad de las diferentes partes de la planta, donde las raíces resultaron más activas, seguidas de forma descendente por hojas, semillas, flores y las ramas, que fueron las de menor actividad. En los extractos provenientes de los tejidos formados in vitro se encontró menor actividad que en los ex vitro, y los callos provenientes de pétalos resultaron los menos activos en comparación con el total de extractos que se evaluaron. Los callos de nucelas mostraron mayor actividad que los de pétalos y que las ramas, los de estaminoides fueron los más activos de los tejidos provenientes del cultivo in vitro, con mayor actividad que ramas y semillas.
Las ramas y flores mostraron la mayor actividad antioxidante relacionada con las menores concentraciones de malondialdehído y otros aldehídos, aunque mostraron menor contenido de compuestos fenólicos que el resto de los órganos evaluados; este comportamiento difiere también del que se obtuvo en el ensayo DPPH. Esto puede estar relacionado con que los compuestos presentes en los extractos acuosos (ensayo actividad de sustancias reactivas al ácido tiobarbitúrico) varíen con respecto a los que se encuentran en los extractos alcohólicos (fenoles y ensayo DPPH). Por esta razón tienen diferentes niveles de actividades antioxidantes para los distintos mecanismos de inhibición de los procesos de oxidación, o sea, que aunque los niveles de compuestos fenólicos en un tejido sean superiores a otros, todos los compuestos fenólicos no poseen igual actividad antioxidante, por lo que la actividad de los compuestos fenólicos del extracto de un determinado tejido debe estar relacionada directamente con el tipo de compuesto fenólico y no con la concentración total. Esta relación pudiera estar dada por la capacidad antioxidante de compuestos fenólicos presentes en esos órganos, lo cual evita el efecto nocivo de los radicales libres formados en las hojas. Por lo tanto los resultados que se obtuvieron proporcionan una información básica prometedora para el uso potencial de extractos metanólicos y acuosos de T. cacao como antioxidante.
REFERENCIAS BIBLIOGRÁFICAS
1. Kolewe ME, Gaurav V, Roberts SC. Pharmaceutically active natural product synthesis and supply via plant cell culture technology. Molecular Pharmaceutics. 2008;5:243-56.
2. McChesney JD, Venkataraman SK, Henri JT. Plant natural products: Back to the future or into extinction? Phytochemistry. 2007;68:2015-22.
3. Zárate R, Jaber-Vazdekis N, Cequier-Sánchez E, Gutíerrez-Nicolás F, Ravelo A. Biotechnology for the production of plant natural products. En: Studies in Natural Products Chemistry, 34.The Netherlands: Elsevier Science Publishers; 2008. p. 309-92
4. Bourgaud F, Gravot A, Milesi S, Gontier E. Production of plant secondary metabolites: a historical perspective. Plant Science. 2001;161:839-51.
5. Oksman-Caldentey KM, Inzé D. Plant cell factories in the post-genomic era: new ways to produce designer secondary metabolites. Trends in Plant Science. 2004;9:433-40.
6. Niemenak N, Rohsius Ch, Elwers S, Ndoumou DO, Lieberei R. Comparative study of different cocoa (Theobroma cacao L.) clones in terms of their phenolics and anthocianins contents. J Food Composition Analysis. 2006;19:612-9.
7. Rein D, Paglieroni TG, Wun T, Pearson DA, Schmitz HH, Gosselin R, et al. Cocoa inhibits platelet activation and function. Am J Clin Nutr. 2000;72:30-5.
8. Matkowski A. Plant in vitro culture for the production of antioxidants. Biotechnol Advance. 2008;26:548-60.
9. Mishchenko NP, Fedoreev SA, Bryukhanov VM, Zverev YF, Lampatov VV, Azarova OV, et al. Chemical composition and pharmacological activity of anthraquinones from Rubia cordifolia cell culture. Pharm. Chemistry J. 2007;41:605-9.
10. Shinde AN, Malpathak N, Fulzele DP. Determination of isoflavone content and antioxidant activity in Psoralea corylifolia L. callus cultures. Food Chemistry. 2010;118:128-32.
11. López-Laredo AR, Ramírez-Flores FD, Sepúlveda-Jiménez G, Trejo-Tapia G. Comparison of metabolite levels in callus of Tecoma stans (L.) Juss. ex Kunth cultured in photoperiod and darkness. In Vitro Cell Dev Biol Plant. 2009;45:550-8.
12. Edwards HGM, Jorge Villar SE, de Oliveira LFC, Le Hyaric M. Analytical Raman spectroscopic study of cacao seeds and their chemical extracts. Analytica Chimica Acta. 2005;538:175-80.
13. Li Z, Traore S, Maximova S, Gultinan MJ. Somatic embryogenesis and plant regeneration from floral explants of Cacao (Theobroma cacao L.) using thidiazuron. In Vitro Cell Dev Biol Plant. 1998;34:293-9. PSU Invention Disclosure # 97-1736.
14. Chatelet P, Michaux-Ferrière N, Dublin P. Potentialités embryogenèse du nucelle et du tégument interne de graines immatures de cacaoyer (Theobroma cacao L.). C. R. Acad Sci Paris. 1992;3:55-62.
15. Figueira A, Janik J. Development of nucellar somatic embryos of Theobroma cacao L. Acta Horticulturae. 1993;336:231-6.
16. Lopez-Baez O, Bollon H, Esques AB. Embryogenèse somatique de cacaoyer Theobroma cacao L. à partir de pièces florales. Compte-rendu de Académie des Sciences París. 1993;316:579-84.
17. Alemanno L, Berthouly M, Michaux-Ferrière N. Embryogenès somatique du cacaoyer à partir de pièces florales. Plantations, Recherche, Development. 1996;3(4):225-37.
18. Alemanno L, Berthouly M, Michaux-Ferriere NA. Comparison between Theobroma cacao L. zygotic embryogenesis and somatic embryogenesis from floral explants. In Vitro Cell Dev Biol Plant. 1997;33(3):163-72.
19. Alemanno L, Ramos T, Gargadenec A, Andary C, Ferriere N. Localization and identification of phenolic compounds in Theobroma cacao L. somatic embryogenesis. Annals Botany. 2003;92:613-23.
20. Martínez F, Cabrera M, Hernández O, Rodríguez DM, Ramos R. Prueba de diferentes concentraciones y medios de cultivo para embriones de Theobroma cacao Lin. Café Cacao. 2001;2(1):28-32.
21. Silva Pupo JJ, Montes S, Acosta L, Arias E, García A, Pupo A, et al. Avances en la embriogénesis somática de cacao (Theobroma cacao L.) en Cuba. Café Cacao. 2002;3(2):27-30.
22. Niemenak N, Saare-Surminski K, Rohsius Ch, Ndoumou DO, Lieberei R. Regeneration of somatic embryos in Theobroma cacao L. in temporary immersion bioreactor and analyses of free amino acids in different tissues. Plant Cell Rep. 2007;19:612-9.
23. Benson EE. In vitro plant recalcitrance: an introduction. In Vitro Cell Dev Biol Plant. 2000;36:141-8.
24. Gurr SI, Mc Pherson MI, Bowles DJ. Lignin and associated phenolic acids in cell walls. En: D. L. Wilkinson. Molecular plant pathology: a practical approach. III Oxford: IRL Press; 1992. p. 51-9.
25. Harding K, Benson EE. Genetic Preservation of Plant Cells. Berlin: BWW Grout. Springer Verlag; 1995. p. 113-69.
26. Ait Barka E, Kalantari S, Makhlouf J, Arul J. Effects of UV-C irradiation on lipid peroxidation markers during ripening of tomato (Lycopersicon esculentum L.) fruits. Aust J Plant Physiol. 2000;27:147-52.
27. Hanato T, Kagawa H, Yasuhara T, Okuda T. Two new flavonoids and other constituents in licorice root: their relative astringency and radical scavenging effects. Chem Pharm Bull. 1988;36:2090-7.
28. Zapata J, Hernandez M, Ojeda M, Benlloch M, Prast E, Tena M, et al. Toxic metals accumulation and total soluble phenolics in Sunflower and Tobacco plans. Plant Physiol Biochem. 2000;38:178-80.
29. Pratt DE, Hudson BJF. Natural oxidants not exploited commercially. Food Antioxidants. In: Hudson BJF, editor. Food antioxidants. Amsterdam. New York, U. S. A: Ed. Elsevier; 1990. p. 171-92.
30. Traore A, Guiltinan MJ. Effects of carbon source and explant type on somatic embryogenesis of four cacao genotypes. Hort Science. 2006;41(3):753-8.
31. Mohd Zin Z, Abdul Hamid A, Osman A, Saari N. Antioxidative activities of chromatographic fractions obtained from root, fruit and leaf of Mengkudu (Morinda citrifolia L.). Food Chemistry. 2004;94:169-78.
32. Bitschm R. Pflanzenphenole und ihre gesunsheitliche Wirkung. Natura Rdsch. 1996;49:47-51.
33. Cook NC, Samman S. Flavonoids-chemistry metabolism, cardioprotective effects and dietary sources. Nutricional Biochem. 1996;7:66-76.
34. Lee KW, Kim YJ, Lee HJ, Lee CY. Cocoa has more phenolic phytochemicals and a higher antioxidant capacity than teas and red wine. J Agricultural Food Chem. 2003;51:7292-5.
35. Tan CL, Furtek DB. Development of an in vitro regeneration system for Theobroma cacao from mature tissues. Plant Sciences. 2003;164:407-12.
36. Murthy BNS, Murch SJ, Saxena P. Thidiazuron: a potent regulator of in vitro plant morphogenis. In Vitro Cell Dev Biol Plant. 1998;34(6):267-75.
37. George EF, Hall MA, De Klerk GJ. Plant propagation by tissue culture. 3rd ed. Springer, Dordrecht: The Netherlands; 2008. p. 29-227.
38. Martinez ME, Mora N, Quiñones J, Gonzalez MT, Engelmann F, Lorenzo JC. Effect of cryopreservation on the structural and functional integrity of cell membranes of sugarcane (Saccharum sp.) embryogenic calluses. Cryo Letters. 2002;23(4):237-44.
39. Wagner S, Alviano D, Alviano S, Claudio G, Diniz A, Antoniolli R, et al. In vitro antioxidant potential of medicinal plant extracts and their activities against oral bacteria based on Brazilian folk medicine. Archives Oral Biology. 2008;53:545-55.
Recibido: 1 de diciembre de 2011.
Aprobado: 10 de octubre de 2012.
Janet Quiñones Gálvez. Centro de Bioplantas, Universidad de Ciego de Ávila. Carretera a Morón, Km 9. Ciego de Ávila, CP. 69450. Cuba. Teléf.: (053-33) 224016, Fax: 053-33 266340. Correo electrónico: jquinones@bioplantas.cu