ARTÍCULO ORIGINAL
Actividad antibacteriana y determinación de la composición química de los aceites esenciales de romero (Rosmarinus officinalis), tomillo (Thymus vulgaris) y cúrcuma (Curcuma longa) de Colombia
Antibacterial activity and chemical composition of essential oils of rosemary (Rosmarinus officinalis), thyme (Thymus vulgaris) and turmeric (Curcuma longa) from Colombia
Dr. C. Carlos Andrés Coy Barrera, MSc. Gema Eunice Acosta
Universidad Militar Nueva Granada. Bogotá D.C., Colombia.
Introducción: se estudió
la composición química por cromatografía gaseosa-espectrometría
de masa de tres aceites esenciales extraídos de romero, tomillo y cúrcuma,
plantas muy utilizadas en Colombia para la industria alimentaria, en especial
como condimento. Adicionalmente se evaluaron estos aceites obtenidos frente
a dos cepas grampositivas y dos cepas gramnegativas.
Objetivo: determinar la composición química y las constantes
físicas (densidad e índice de refacción) de los aceites
esenciales de romero, tomillo y cúrcuma en 3 meses diferentes del año,
así como evaluar la actividad antibacteriana de cada uno frente a Staphylococcus
aureus ATCC 6538 y Enterococcus faecalis ATCC 29212, Escherichia
coli ATCC 25922 y Salmonella tiphymurium ATCC 14028s.
Métodos: los aceites esenciales se obtuvieron a partir del material
vegetal fresco, en un equipo de destilación por arrastre con vapor, luego
se caracterizaron por cromatografía gaseosa-espectrometría de
masa y según los protocolos reportados en la literatura, se obtuvieron
sus propiedades físicas; la actividad antibacteriana se hizo mediante
la metodología de difusión en agar modificado.
Resultados: mediante el análisis de los aceites por cromatografía
gaseosa-espectrometría de masa se pueden observar los componentes mayoritarios
de cada una de las plantas. Para el caso del romero resultó piperitona
(21,9 %), α-pineno (14,9 %) y linalool
(14,9 %); para el tomillo 1,8-cineol (21,5 %) y o-cimeno (17,9 %); y
para la cúrcuma, turmerona (36,9 %), α-turmerona
(18,9 %) y ß-turmerona (13,6 %).
Además, los resultados de los aceites esenciales de la actividad antibacteriana
in vitro frente a cepas grampositivas y gramnegativas por el método
de difusión en agar modificado, con la cepa Staphylococcus aureus
que resultó ser el microorganismo más sensible.
Conclusiones: se determinaron los componentes de cada uno de los aceites
esenciales y aunque se recolectaron en 3 meses diferentes del año su
composición química no varió; además, las propiedades
físicas encontradas de cada uno de los aceites se compararon con estudios
previos, por otra parte, los aceites inhiben la cepa bacteriana de Staphylococcus
aureus con un porcentaje considerable.
Palabras clave: actividad antibacteriana, aceites esenciales, romero, cúrcuma, tomillo.
Introduction: the chemical composition
of three essential oils extracted from rosemary, thyme and turmeric was determined
by gas chromatography mass spectrometry. These plants are commonly used in the
Colombian food industry, mostly as seasonings. The oils were also evaluated
against two gram-positive and two gram-negative strains.
Objective: determine the chemical composition and physical constants (density
and refractive index) of essential oils of rosemary, thyme and turmeric in 3
different months of the year, and evaluate the antibacterial activity of each
against Staphylococcus aureus ATCC 6538 and Enterococcus faecalis
ATCC 29212, Escherichia coli ATCC 25922 and Salmonella typhimurium
ATCC 14028s.
Methods: the essential oils were obtained from fresh plant material using
a steam distillation apparatus. They were then characterized by gas chromatography
mass spectrometry following the protocols reported in the bibliography. Determination
was made of the physical properties of the oils. Antibacterial activity was
determined by the modified agar diffusion method.
Results: analysis of the oils by gas chromatography mass spectrometry revealed
the most abundant components in each of the plants. These were piperitone (21.9
%), α-pinene (14.9 %) and linalool (14.9%) for rosemary; 1,8-cineole
(21.5 %) and o-cymene (17.9 %) for thyme; and turmerone (36.9 %), α-turmerone
(18.9 %) and ß-turmerone (13.6 %) for turmeric. The antibacterial
activity of the essential oils against gram-positive and gram-negative strains
was determined in vitro by the modified agar diffusion method. The Staphylococcus
aureus strain was found to be the most sensitive microorganism.
Conclusions: determination was made of the components of each essential
oil. Despite the fact that they were collected in 3 different months of the
year, their chemical composition remained unaltered. The physical properties
found in each oil were compared with those reported by previous studies. The
oils inhibit the Staphylococcus aureus bacterial strain in a considerable
proportion.
Key words: antibacterial activity, essential oils, rosemary, turmeric, thyme.
INTRODUCCIÓN
Las investigaciones actuales han enfocado sus estudios en la búsqueda de compuestos que posean usos como agentes terapéuticos, con la finalidad de controlar las diferentes enfermedades que derivan de los microorganismos,1,2 para ello el uso de los aceites esenciales ha tomado un papel importante en esta búsqueda, porque muchas veces la mezcla de componentes terpénicos, (oxigenados varios de ellos), presentan algún tipo de actividad frente a bacterias comunes.3,4 Por tal motivo, resulta necesario encontrar nuevos compuestos que tengan efectos antibacterianos porque para el caso de las infecciones microbianas, el desarrollo de resistencia es el resultado inevitable del uso indiscriminado de antibióticos, lo que limita la eficacia y el tiempo de vida útil de cada uno; y aunque el uso correcto de compuestos con actividad antibacteriana, disminuirá el desarrollo de resistencias, no lo evitará. Solo el descubrimiento y desarrollo continuo de nuevos fármacos y nuevas aplicaciones puede sobrellevar este problema.
Como las bacterias pueden evadir los efectos letales de los antibióticos a través de varios mecanismos, lo que se requiere actualmente son agentes antibacterianos con mecanismos de acción novedosos; por ende, las fuentes naturales pueden ayudar a la obtención de varias sustancias o mezclas, lo anterior conociendo que más de 30 % de las personas en ciudades industrializadas sufren infecciones de tipo bacteriano.5,6 Esto resalta la importancia de realizar estudios en aceites esenciales para obtener una posible alternativa terapéutica con promisoria actividad antibacteriana.
MÉTODOS
Materiales y equipos
Las muestras frescas de hojas y tallo de romero, tomillo y cúrcuma se recolectaron en cultivos del municipio de Fusagasugá-Cundinamarca, las fechas en las que se realizaron las colectas fueron: septiembre 19, octubre 22 y noviembre 19 de 2011, respectivamente. Cada muestra se clasificó en el Herbario Nacional Colombiano, para el caso de Rosmarinus officinalis COL 387717, para el caso de Thymus vulgaris bajo COL000056203 y para el caso de la Curcuma longa COL000023703.
Las muestras frescas se trasladaron al laboratorio de Productos Naturales de la Universidad Nacional de Colombia bajo refrigeración a una temperatura de 4 ºC, posteriormente se hizo la extracción del aceite esencial a 1 kg de material proveniente de cada especie, procedimiento que se realizó en un equipo de destilación por arrastre con vapor durante 2 h cada uno, el aceite esencial obtenido de cada muestra se separó de la capa acuosa, se secó con sulfato de sodio anhidro y se filtró, con este producto se establecieron la densidad específica y el índice de refracción.7 Una alícuota se envió para establecer su composición química. Se determinaron los índices de Kovats analizando de conjunto la muestra con una mezcla de n-alcanos (C8 a C22).8,9 Los espectros de masas se realizaron en un equipo Hewlett Packard 5973 GC/MS (cromatografía gaseosa-espectrometría de masa) a 70 eV, equipado con un inyector automático, utilizando una columna capilar HP-5MS (30 m, 0,25 mm, 0,25 mm). El programa de temperatura utilizado fue el mismo que se indicó para el análisis cromatográfico. Se inyectó una muestra de 1,0 mL de una solución al 2 % del aceite esencial en n-hexano con reparto de 100:1. Se utilizó una temperatura de inyección de 200 ºC. La identificación de los componentes de los aceites se realizó mediante comparación computarizada de los espectros obtenidos con los espectros de una Librería Wiley (6ta. edición).
Medios para cultivo bacteriano y otros reactivos
Para los cultivos y subcultivos de las cepas grampositivas se utilizó caldo de tripticasa de soya (TSB; Difco Laboratories, Detroit, MI, USA). En los cultivos y subcultivos de las cepas gramnegativas se empleó base Luria Broth (LB; Gibco, Cerdanyola del valle, Barcelona, España). Para realizar la dispersión bacteriana en los ensayos de difusión radial se empleó medio dispersivo bajo en nutrientes preparado con 10 g de agarosa de baja electro-endosmosis (Sigma Chem. Co, St. Louis, MO, USA), Tween-20 al 0,02 (v/v) (Merck, Darmstadt, Alemania) y 0,3 g de TSB (tripticasa de soya) (Difco Laboratories, Detroit, MI, USA) para un volumen final de 1 L de solución. En la detección del crecimiento bacteriano se empleó un medio nutritivo revelador en una sobrecapa mediante la mezcla de los componentes siguientes: 20 g de agar-agar (Difco Laboratories, Detroit, MI. USA), tween-20 al 0,02 (v/v) (Merck, Darmstadt, Alemania) y 10 g de tripticasa de soya (TSB), buffer fosfato salino (PBS) pH 7,2-7,4 se preparó de la manera siguiente: 0,2 g KH2PO4, 32 g NaCl, 0,8 g de KCl, 4,6 g de Na2HPO4 para un volumen de 1 L de solución. Como controles positivos se utilizaron los antibióticos ampicilina (A) 50,8 mg/mL, (Binotal; Bayer® Alemania), sulfato de kanamicina (K) 10,25 mg/mL (Gibco, Cerdanyola del valle, Barcelona, España), tetraciclina monohidratada (T) 4,12 mg/mL (Sigma Chem. Co, St. Louis, MO, USA) y 10 g de tripticasa de soya (TSB), buffer fosfato salino (PBS) pH 7,2-7,4 se preparó de la manera siguiente: 0,2 g KH2PO4, 32 g NaCl, 0,8 g de KCl, 4,6 de Na2HPO4 para un volumen de 1 L de solución. Como controles positivos se utilizaron los antibióticos ampicilina (A) 50,8 mg/mL (Binotal; Bayer® Alemania), sulfato de kanamicina (K) 10,25 mg/mL (Gibco, Cerdanyola del valle, Barcelona, España), tetraciclina monohidratada (T) 4,12 mg/mL (Sigma Chem. Co, St. Louis, MO, USA).
Ensayo de actividad antibacteriana
La actividad antibacteriana se evaluó frente a cepas de bacterias grampositivas: Staphylococcus aureus ATCC 6538 y Enterococcus faecalis ATCC 29212 y gramnegativas: Escherichia coli ATCC 25922 y Salmonella tiphymurium ATCC 14028s, aportadas para este estudio por el profesor E. A. Groisman del Departamento de Microbiología Molecular de la Universidad de Washington, St. Louis, MO, USA. La actividad antibacteriana del compuesto se evaluó por la técnica de difusión radial adaptada de la metodología publicada por Lehrer y otros,10 y se realizó en la Fundación Instituto de Inmunología de Colombia (FIDIC), según el protocolo reportado previamente,11,12 se obtuvieron los respectivos porcentajes de inhibición de crecimiento bacteriano.
RESULTADOS
En la tabla 1 se muestra la composición química del aceite de R. officinalis, con la presencia de 20 compuestos, dentro de los cuales los componentes mayoritarios corresponden a piperitona (23,7 %), linalool (14,9 %) y á-pineno (14,9 %), este aceite se compone de 11 monoterpenos oxigenados, 6 monoterpenos no oxigenados, 2 sesquiterpenos oxigenados y 1 no oxigenado.
Tabla 1. Composición química del aceite esencial de Rosmarinus officinalis
|
No. |
Compuestos |
Índice de refracción |
% |
|
1 |
α-pineno |
934 |
14,9 |
|
2 |
Camfeno |
945 |
3,33 |
|
3 |
3-octanona |
966 |
1,61 |
|
4 |
Sabineno |
972 |
0,56 |
|
5 |
Mirceno |
982 |
2,07 |
|
6 |
o-cimeno |
1 013 |
0,71 |
|
7 |
1,8-cineol |
1 024 |
7,43 |
|
8 |
Linalool |
1 089 |
14,9 |
|
9 |
Mircenol |
1 204 |
0,75 |
|
10 |
Camfor |
1 127 |
4,97 |
|
11 |
Borneol |
1 155 |
3,68 |
|
12 |
Terpine-4-ol |
1 166 |
1,70 |
|
13 |
α-terpineol |
1 177 |
0,83 |
|
14 |
Verbinona |
1 187 |
1,94 |
|
15 |
Piperitona |
1 246 |
23,7 |
|
16 |
Acetato de bornilo |
1 274 |
3,08 |
|
17 |
β-cariofileno |
1 424 |
2,68 |
|
18 |
Farneseno |
1 448 |
1,26 |
|
19 |
Germacreno |
1 481 |
0,52 |
|
20 |
Bisabolol |
1 673 |
1,01 |
Para el caso del aceite esencial de T. vulgaris, se encontraron 30 componentes (tabla 2), de los cuales el ß-pineno (29,0 %), el 1,8-cineol (21,5 %) y el o-cimeno (17,9 %) resultaron ser los componentes mayoritarios, además 12 de los componentes del aceite esencial corresponden a terpenoides no oxigenados, 13 son terpenoides oxigenados, 1 sesquiterpeno oxigenado y 4 sesquiterpenos no oxigenados.
Tabla 2. Composición química del aceite esencial de Thymus vulgaris
|
No. |
Compuestos |
Índice de refracción |
% |
|
1 |
Isobutirato de isobutilo |
892 |
0,8 |
|
2 |
α-tujeno |
922 |
0,3 |
|
3 |
α-pineno |
931 |
29 |
|
4 |
Sabineno |
971 |
0,6 |
|
5 |
Mirceno |
981 |
0,2 |
|
6 |
δ-3-careno |
998 |
0,2 |
|
7 |
p-cimeno |
1013 |
0,2 |
|
8 |
Limoneno |
1025 |
0,3 |
|
9 |
1,8-cineol |
1028 |
21,5 |
|
10 |
o-cimeno |
1038 |
17,9 |
|
11 |
γ-terpinoleno |
1051 |
0,1 |
|
12 |
Terpinoleno |
1082 |
0,6 |
|
13 |
Linalool |
1122 |
0,3 |
|
14 |
α-camfolenal |
1130 |
10,4 |
|
15 |
Trans-pinocarveol |
1154 |
0,03 |
|
16 |
γ-terpineol |
1169 |
0,07 |
|
17 |
Terpineno-4-ol |
1180 |
0,09 |
|
18 |
α-terpineol |
1213 |
0,5 |
|
19 |
trans-carveol |
1217 |
3,17 |
|
20 |
cis-carveol |
1242 |
0,4 |
|
21 |
Geraniol |
1248 |
0,07 |
|
22 |
Acetato de linalilo |
1310 |
1,1 |
|
23 |
Geranilato de metilo |
1342 |
4,8 |
|
24 |
Acetato de terpinilo |
1351 |
0,2 |
|
25 |
Acetato de nerilo |
1369 |
1,3 |
|
26 |
Metileugenol |
1430 |
0,09 |
|
27 |
β-cariofileno |
1463 |
1,6 |
|
28 |
α-humuleno |
1562 |
0,2 |
|
29 |
Spatulenol |
1586 |
0,07 |
|
30 |
Epóxido de cariofileno |
1608 |
0,1 |
El aceite esencial de C. longa posee 12 componentes (tabla 3), los componentes mayoritarios son la turmerona (36,9 %), la α-turmerona (18,9 %), y la ß-turmerona (13,6 %), este aceite tiene a diferencia de los dos anteriores 6 sesquiterpenos oxigenados, 3 sesquiterpenos no oxigenados y 3 monoterpenos no oxigenados.
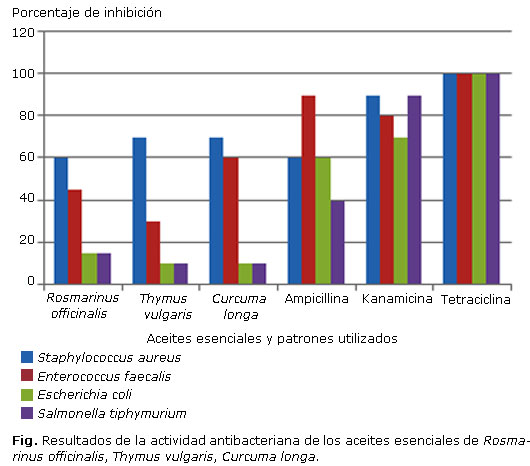
En la figura se exponen los resultados del ensayo de inhibición de crecimiento de las cepas bacterianas, valoradas por el método de difusión en agar para cada uno de los aceites evaluados; esta gráfica también incluye los porcentajes de inhibición presentados por los patrones utilizados en este estudio, los cuales fueron kanamicina, tetraciclina y ampicilina.
Es importante recalcar que a los aceites obtenidos se les determinó la densidad específica y el índice de refracción (tabla 4), para comparar con otros resultados estas propiedades físicas, las cuales resultaron ser muy similares a las reportadas en la literatura.
DISCUSIÓN
Los aceites obtenidos de R. officinalis (romero), T. vulgaris (tomillo) y C. longa (cúrcuma) mostraron luego del análisis correspondiente, perfiles cromatográficos iguales para las 3 recolecciones. La caracterización de cada uno de ellos por CG-EM mostró un alto porcentaje de compuestos del tipo monoterpeno y sesquiterpeno; es así como en el aceite de romero se pudo observar que de los 20 componentes determinados, 55 % era de monoterpenos oxigenados y 35 % de sesquiterpenos no oxigenados; en el aceite de tomillo de los 30 componentes encontrados, 43 % se corresponde a monoterpenos no oxigenados, 40 % a monoterpenos oxigenados y porcentajes más pequeños de compuestos tipo sesquiterpeno; en el aceite de cúrcuma se lograron determinar 12 componentes, de los cuales la mayoría son del tipo sesquiterpeno, predominando 50 % de sesquiterpenos oxigenados y 25 % de sesquiterpenos no oxigenados. Para este último de los aceites esenciales la cantidad de compuestos del tipo monoterpeno es menor respecto a los dos aceites anteriores, teniendo en cuenta la bibliografía se encuentran algunas similitudes con respecto a los componentes mayoritarios de cada muestra.13-15
En la evaluación de la actividad antibacteriana de los aceites esenciales, teniendo en cuenta los patrones utilizados se observa que existen porcentajes de inhibición altos, incluso comparables con la ampicilina; de acuerdo a ello, de los tres aceites evaluados frente a la cepa de S. aureus, se pueden observar porcentajes de inhibición de 60 % para el caso del aceite de romero y 70 % en los aceites de tomillo y cúrcuma, respectivamente. Resulta interesante ver que estos dos últimos aceites se caracterizan porque poseen un porcentaje representativo de monoterpenos no oxigenados, con respecto al aceite de romero.
La otra cepa evaluada que produjo resultados con respecto a los porcentajes de inhibición corresponde a E. faecalis, otra bacteria grampositiva, con porcentajes de inhibición de 40 % del aceite de romero, 20 % para el aceite de tomillo y 50% para el caso de la cúrcuma, esto puede indicar que posiblemente el aceite de cúrcuma es de los más activos, porque en sus componentes principales posee un porcentaje alto de sesquiterpenos oxigenados, confirmado por estudios anteriores que reportan resultados similares.16
Los aceites evaluados no presentan porcentajes de inhibición representativos frente a las cepas gramnegativas E. coli y S. tiphy. Por su parte los resultados de densidad e índice de refracción son comparables con los obtenidos en la literatura,17-19 lo cual complementa su caracterización.
Este trabajo muestra el estudio de tres especies aromáticas muy utilizadas en Colombia con fines de carácter culinario, medicinalmente no se poseen estudios representativos, lo que amerita continuar con estos para obtener nuevos componentes que sirvan como agentes antibacterianos. Por esta razón es que los aceites esenciales resultan ser de nuevo una fuente importante para lograr este objetivo, además, si a esto se le agrega que el cultivo de romero, tomillo y cúrcuma es bastante sencillo, permite postularlos como una alternativa interesante.
Los aceites de las especies en estudio no mostraron cambios respecto a su composición química en las tres recolecciones realizadas entre septiembre y noviembre del año pasado, se sugiere colectar muestras en otras épocas del año para determinar si existe algún tipo de variación respecto a sus componentes.
AGRADECIMIENTOS
A la Universidad Nacional de Colombia, al grupo de productos Naturales Vegetales por la obtención del aceite esencial y por el equipo de CG-EM, a la Universidad Militar Nueva Granada por permitir la realización de este estudio mediante la aprobación del proyecto de la convocatoria interna I-2013 que promueve la formación de investigadores desde los semilleros, a los estudiantes Juan Camilo Carreño y Miguel Ángel Sarmiento, así como a la investigadora Melba Rodríguez por su colaboración durante esta investigación.
REFERENCIAS BIBLIOGRÁFICAS
1. Gibbons S. Anti staphylococcal plant natural products. Nat Prod Res. 2004;21:263 77.
2. Gibbons S. Plants as a source of bacterial resistance modulators and antiinfective agents. Phytochemistry Reviews. 2005;4:63-78.
3. Eteghad SS, Mirzaei H, Pour SF, Kahnaui S. Inhibitory effects of endemic, Thymus vulgaris and Menta piperita essential oils on Escherichia coli O157:H7. Research J Biol Sci. 2009;4(3):340-4.
4. Jarrar N, Abu-Hijleh, Adwan K. Antibacterial activity of Rosmarinus officinalis L. alone and in combination with cefuroxime against methicillin-resistant Staphylococcus aureus. Asian Pacific J Trop Med. 2010;121-3.
5. Albado PE, Saez FG, Grabiel A. Composición química y actividad antibacteriana del aceite esencial del Origanum vulgare (orégano). Rev Med Hered. 2001;12:16-9.
6. Martínez J, Ferrer BSD, Rodríguez GOD. Actividad antibacteriana del aceite esencial de mandarina. Rev Fac Agronomía. 2003;20:502-12.
7. Rincón CA, Castaño JC, Osorio C, Ríos E. Actividad biológica de los aceites esenciales de Acmella ciliata (Kunth ) Cass. Rev Cubana Plant Med. 2012;17(2):160-71.
8. Celiktas OY, Kocabas EH, Bedir E, Sukan FV, Ozek T, Baser KHC. Antimicrobial activities of methanol extracts and essential oils of Rosmarinus officinalis, depending on location and seasonal variations. Food Chem. 2007;100(2):553-9.
9. Rota MC, Herrera A, Martínez RM, Sotomayor JA, Jordán MJ. Antimicrobial activity and chemical composition of Thymus vulgaris, Thymus zygis and Thymus hyemalis essential oils. Food Control. 2008;19(7):681-7.
10. Lehrer R, Rosenman M, Jackson R, Einsenhauer P. Ultrasensitive assays for endogenous antimicrobial polypeptides. J Immunol Meth. 1991;137:167-73.
11. Cuca LE, Patarroyo ME, Lozano JM, Delle Monache F. Biological activity of secondary metabolites from Peltostigma guatemalensis. Nat Prod Res. 2009;23:370-4.
12. Cuca LE, Bernal FA, Coy CA, Coy ED. Essential oil composition and antimicrobial activity of fruits of Iryanthera ulei W. from Colombia. J Chil Chem Soc. 2009;54:363-5.
13. Hussain AI, Anwar F, Chata S, Jabbar A, Mahboob S, Nigan P. Rosmarinus officinalis essential oil: Antiproliferative, antioxidant and antibacterial activities. Braz J Microbiol. 2010;41:1070-8.
14. Rota MC, Herrera A, Martínez RM, Sotomayor JA, Jordán MJ. Antimicrobial activity and chemical composition of Thymus vulgaris, Thymus zygis and Thymus hyemalis essential oils. Food Control. 2008;19(7):681-7.
15. Li S, Yuan W, Deng G, Wang P, Yang P, Aggarwal BB. Chemical composition and product quality control of Turmeric (Curcuma longa L), Pharm Crops. 2011;2:28-54.
16. Tsai S, Huang SJ, Chyau CC, Tsuai CH, Weng CC, Mau J-L. Composition and antioxidant properties of essential oils from curcuma rhizome. Asian J Arts Sciences. 2011;2(1):57-66.
17. De Azerêdo GA, Montenegro TL, Bressan RG, Leite de Souza E. The cytotoxic effect of essential oils from Origanum vulgare L. and/or Rosmarinus officinalis L. on Aeromonas hydrophila Foodborne Pat Dis. 2012;9(4):298-304.
18. Soto Mendivil EA, Moreno Rodríguez JF, Estarrón Espinosa M, García Fajardo JA, Obledo Vázquez EN. Chemical composition and fungicidal activity of the essential oil of Thymus vulgaris against Alternaria citri. e-Gnosis. 2006;4:1-8.
19. Apisariyakul A, Vanittanakom N, Buddhasukh DJ. Antifungal activity of turmeric oil extracted from Curcuma longa (Zingiberaceae). Ethnopharmacol. 1995;49(3):163-9.
Recibido: 1 de agosto de 2012.
Aprobado: 30 de diciembre de 2012.
Carlos Andrés Coy Barrera. Grupo Integrado de investigación en Química y Biología. Facultad de Ciencias Básicas y Aplicadas. Departamento de Química Universidad Militar Nueva Granada. Carretera 11 101-80. Bogotá D.C. Colombia Teléf.: +037 6500000 Ext 1525. Correo electrónico: carlos.coy@unimilitar.edu.co