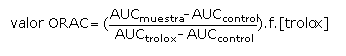 (2)
(2)
ARTÍCULO ORIGINAL
Efecto de la fermentación sobre la actividad antioxidante de diferentes clones de cacao colombiano
Effect of fermentation on the antioxidant activity of different Colombian cocoa clones
MSc. Sandra Zapata Bustamante, MSc. Angélica Tamayo Tenorio, Dr. C. Benjamín Alberto Rojano
Universidad Nacional de Colombia, Sede Medellín. Medellín, Colombia.
Introducción: el cacao
es una de las principales fuentes de polifenoles. Estos compuestos se encuentran
relacionados con la actividad antioxidante y las características organolépticas
del cacao y sus subproductos. Durante el procesamiento, los granos de cacao
son sometidos a diferentes etapas que pueden afectar el contenido de esos metabolitos,
pero que son cruciales para el desarrollo de la calidad organoléptica.
Una de estas etapas es la fermentación.
Objetivo: evaluar el efecto de la fermentación sobre el contenido
de metabolitos secundarios y la actividad antioxidante en 5 clones de cacao
cultivados en Colombia.
Métodos: en los clones estudiados se determinó el contenido
de fenoles totales, antocianinas totales y taninos condensados, mediante métodos
espectrofotométricos; así como catequina, epicatequina, teobromina
y cafeína por cromatografía líquida de alta resolución.
La capacidad antioxidante se evaluó mediante las metodologías
del DPPH. (1,1-diphenyl-2-picrylhydrazyl), FRAP (ferric
reducing antioxidant power), ORAC (oxygen radical antioxidant capacity)
y la capacidad atrapadora de radicales superóxido.
Resultados: el efecto de la fermentación sobre los clones de cacao
no fue uniforme, observándose tanto cambios positivos como negativos
en los contenidos de los diversos metabolitos secundarios y la actividad antioxidante,
en dependencia de la variedad. Sin embargo, los cambios en la actividad antioxidante
expresada como TEAC (trolox equivalent antioxidant capacity) DPPH están
correlacionados con los diversos cambios en el contenido de fenoles totales
durante el proceso de fermentación y descritos por la expresión
siguiente: DDPPH= 6,36099*Dfenoles+5,10923,
con r2= 0,982.
Conclusiones: la fermentación afecta el potencial antioxidante de
los clones de cacao, lo cual es importante para el desarrollo de las propiedades
organolépticas de los productos finales.
Palabras clave: cacao, fermentación, compuestos fenólicos, metilxantinas, actividad antioxidante.
Introduction: cocoa is one of the main
sources of polyphenols. These compounds are related with the antioxidant activity
and sensory characteristics of cocoa and its sub-products. During processing,
cocoa beans are subjected to different stages, which may affect the content
of these metabolites. However, these processes are crucial in the development
of organoleptic quality of cocoa beans. One of these stages is the fermentation.
Objective: to evaluate the effect of fermentation on the content of secondary
metabolites and the antioxidant activity in five Colombian cocoa clones.
Methods: the total phenol content, total anthocyanins and condensate tannins
were determined for the studied clones by spectrophotometric methods. Additionally,
the content of catechin, epicatechin, theobromine and caffeine were determined
by high-performance liquid chromatography (HPLC). The antioxidant capacity of
cocoa clones was determined by the methods DPPH. (1,1-diphenyl-2-picrylhydrazyl),
FRAP (ferric reducing antioxidant power), ORAC (oxygen radical absorbance capacity)
and superoxide radical scavenging capacity.
Results: the effect of fermentation on cocoa clones was not uniform. Both
positive and negative changes in the contents of various secondary metabolites
and antioxidant activity were observed depending on the variety. However, changes
in antioxidant activity expressed as TEAC (trolox equivalent antioxidant capacity)
DPPH were correlated with the changes in the total phenol content during fermentation
and described by the following expression: DDPPH=
6.36099* Dphenols + 5.10923, with r2 =
0.982.
Conclusions: fermentation affects the antioxidant potential of cocoa clones,
which is important for the development of organoleptic properties of final products.
Key words: cocoa, fermentation, phenolic compounds, methylxanthines, antioxidant activity.
INTRODUCCIÓN
Los alimentos como frutas, vegetales y granos son reportados por contener una alta variedad de compuestos antioxidantes, incluidos los compuestos fenólicos; los cuales han recibido gran atención debido a sus funciones fisiológicas como antimutagénicos y antimicrobianos.1-3 Los compuestos fenólicos son producidos en el metabolismo secundario de las plantas y desempeña un papel importante en los procesos de maduración, mecanismos de defensa y caracterización sensorial de los productos alimenticios derivados de las plantas.4,5
El cacao (Theobroma cacao L.), es en particular rico en polifenoles, estos representan entre 12 y 18 % del peso seco de los granos, y se encuentran fuertemente asociados con la actividad antioxidante y con las características organolépticas de los productos elaborados a partir del cacao.3,4,6 Los polifenoles en los granos de cacao son almacenados en las células pigmentarias de los cotiledones, y le aportan colores que van desde el blanco hasta un morado oscuro, dependiendo de la cantidad de antocianinas almacenadas.7 En los frutos de cacao se pueden distinguir 3 tipos de polifenoles: catequinas o flavan-3-oles (37 %), antocianinas (4 %) y proantocianidinas (58 %). La principal catequina es (-)-epicatequina con un máximo de hasta 35 % del contenido de polifenoles. También se han encontrado en cantidades menores (+)-catequina, (+)-galocatequina y (-) epigalocatequina.4,8
La fermentación y el secado son pasos críticos en el procesamiento del cacao, causan descomposición de las paredes de las células pigmentarias; sus contenidos quedan expuestos a otros componentes dentro del grano y otorgan otras características físicas y organolépticas, como olor y sabor. En la fermentación aerobia se forman en los granos pigmentos marrones constituidos por polifenoles; la epicatequina y catequina se oxidan a quinonas, y la condensación de las proteínas y polifenoles causan una reducción de la astringencia y sabor amargo. Las quinonas también pueden acomplejarse con aminoácidos, péptidos, proteínas o polimerizar con otros flavonoides.9-11 Los taninos de alto peso molecular se acomplejan con proteínas a través de puentes de hidrógeno, y el resultado de estas reacciones es un pigmento marrón, insoluble en agua. Los granos frescos de cacao contienen pigmentos antocianínicos morados, como el cianidin-3-a-L-arabinosido y cianidin-3-ß-D-galactósido. Durante la fermentación, estos pigmentos son hidrolizados por glicosidasas, que provocan una decoloración de los cotiledones.9,11
Se ha evidenciado que el cacao y sus derivados presentan una gran variedad de propiedades beneficiosas para la salud en humanos. Algunos reportes señalan que el consumo de cacao o chocolate reduce el riesgo de contraer enfermedades cardiovasculares. Varios estudios en humanos han mostrado el efecto de los polifenoles del cacao en los niveles lipídicos, como una disminución en el colesterol total y regulación en la presión arterial sistólica y diastólica. También, inactivan radicales superóxido, hidroxilo y radicales lipídicos; así mismo, inhiben la peroxidación lipídica (LDL) in vitro e in vivo. Además, se ha observado el mejoramiento en la capacidad vasodilatadora de las arterias braquiales, en pacientes con enfermedad de las arterias coronarias, al suministrarles bebidas de cacao.12-16
Aunque la mayoría de los estudios indican que los beneficios en la salud del cacao y sus subproductos son atribuidos a los polifenoles, debe señalarse que los productos de cacao no solo son ricos en polifenoles, también tienen altos contenidos de metilxantinas, que representan alrededor de 3,2 % de la composición del chocolate sin azúcar y sin grasa. Las principales metilxantinas de cacao son la teobromina (3,7 % sobre una base sin grasa) y cafeína (alrededor de 0,2 %). La posible sinergia de las interacciones entre los flavonoides y metilxantinas aún no son claras, sin embargo, se debe considerar la contribución a la salud de la teobromina en los productos de cacao.17 El objetivo de este estudio fue evaluar el efecto de la fermentación sobre el contenido de metabolitos secundarios y la actividad antioxidante por diferentes metodologías, en 5 clones de cacao cultivados en Colombia.
MÉTODOS
Muestras: se utilizaron 5 clones de cacao fermentados y secos (CCN 51, ICS 1, ICS 60, ICS 95 y TSH 565) suministrados por FEDECACAO. El material vegetal de estudio, se recolectó en la "Granja Tierradura", ubicada en el municipio Miranda en el departamento de Cauca. Los frutos en estado de colecta con edades similares y sin presencia de patógenos en su corteza, fueron seleccionados de forma aleatoria en las diferentes partes del árbol. Parte de los granos colectados se fermentaron por un período de 6 días. Los granos de cacao sin fermentar y fermentados se secaron al sol durante 5 días.18
Reactivos y equipos: el radical libre DPPH. (1,1-difenil2-picrilhidrazilo), fosfato ácido de sodio, metanol, ácido acético, tricloruro de hierro, 2,4,6-tri (2-piridil) triazina (TPTZ) se obtuvieron de Aldrich Chem. Co (Millwakee, WI). AAPH [2,20-Azo-bis (2-amidinopropano) dihydrochloride], usado como una fuente de radicales peroxilos, Trolox (ácido 6-hidroxi- 2,5,8-tetrametilchromano-2-carboxylico), fluoresceinato de sodio, ácido ascórbico, catequina, (-)-epicatequina, teobromina y cafeína, se adquirieron de Sigma Chemical Co. (St.Louis, MO). El ácido sulfúrico, vainillina y el reactivo de Folin se recibieron de Merck (Alemania). Las medidas de absorbancia se realizaron en un espectrofotómetro UV-Vis Jenway 6405. Las lecturas de fluorescencia se hicieron en un espectrofluorímetro marca Perkin Elmer modelo LS- 55.
Extracción metanólica: se homogenizaron 10 g de muestra macerada de granos de cacao en 100 mL de metanol. La mezcla se almacenó en un shaker (New Brunswick, Innova 4400) a 150 rpm, 30 ºC durante 48 h y, finalmente, se filtró. El extracto obtenido se utilizó para la determinación de la capacidad antioxidante y el contenido de metabolitos secundarios.
Extracción de metabolitos secundarios para el análisis de HPLC: la preparación del extracto se realizó siguiendo la metodología, modificada, descrita por Gu y otros.19 Se extrajo 1 g de muestra macerada de granos de cacao en 10 mL de metanol en un tubo de polipropileno de 50 mL, mediante ultrasonido durante 15 min en un sonicador (VWR Scientific, B1500A-DTH). El tubo se centrifugó a 4 000 rpm durante 10 min en una centrifuga (Thermo Scientific, Heraeus Biofuge) y el sobrenadante se decantó a un tubo limpio de 50 mL. La muestra se extrajo con otros 10 mL de metanol. Los extractos de metanol se combinaron y fueron filtrados a través de un filtro Sartorius de 0,45 µm antes de la inyección en el equipo.
Determinación de fenoles totales: se determinó por el método de Folin-Ciocalteu. En un tubo de reacción se adicionaron 50 µL del extracto metanólico, 425 µL de agua destilada y 125 µL del reactivo Folin-Ciocalteu (grado analítico, Merck). Se agitó y luego se dejó en reposo por 6 min. Posteriormente se adicionaron 400 µL de Na2CO3 a 7,1 %. Después de 1 h en la oscuridad se leyó la absorbancia a 760 nm.20 Se usaron soluciones de ácido gálico (Sigma-Aldrich®) entre 50 y 500 µg/mL para construir la curva de calibración. Los resultados se expresaron como mg de ácido gálico/g de cacao.
Determinación de taninos condensados: se utilizó una técnica para estimación espectrofotométrica de taninos condensados.21 En un tubo de reacción se adicionaron 230 µL del extracto metánolico y 670 µL de una solución de vainillina 10 000 ppm (en ácido sulfúrico 70 %). Se agitó y se incubó en un baño de agua a 20 °C durante 15 min. Luego se registró la absorbancia a 500 nm. El contenido de taninos se expresó como mg de catequina/g de cacao.
Determinación del contenido total de antocianinas: el contenido de antocianinas totales en los extractos se determinó por el método diferencial de pH. Las lecturas se realizaron a 530 y a 700 nm para la eliminación de interferencias debidas a la turbidez de fondo, en buffer a pH 1,0 y 4,5, utilizando la ecuación 1 y un coeficiente de extinción molar de 26 900. En un tubo de reacción se adicionaron 100 µL del extracto y 900 µL del buffer. Se agitó y luego se dejó en reposo por 30 min.22 Los resultados se expresaron como mg de cianidina-3-glucósido/g de cacao.
A= (A530 - A700)pH 1,0 (A530 - A700)pH 4,5 (1)
Determinación de (+)-catequina y (-)-epicatequina: se realizó mediante un análisis cromatográfico por HPLC (high perfomance liquid cromatography).18 Se utilizó un cromatógrafo líquido (Shimadzu, LC-20AD), equipado con un auto inyector SIL-20A /HT, un módulo de comunicación CBM-20A y un detector con arreglo de fotodiodos (PDA) SPD-M20A, calibrado a 280nm. La separación de (+)-catequina y (-)-epicatequina se llevó a cabo en una columna C-18 ultra acuosa cuyas dimensiones eran 5 µm de tamaño de partícula, 250 mm de longitud y 4,6 mm de diámetro. Como fase móvil se utilizó metanol (A) acidulado con ácido fórmico 0,1 % (B), con gradientes de elución de 0,01 min 60 % de A; 5-12 min 80 % de A; 13-14 min 60 % de A. La razón de flujo de la fase móvil fue 1,0 mL/min. La identificación de los picos se hizo comparando con estándares de (+)-catequina y (-)-epicatequina (Sigma-Aldrich®).
Determinación de teobromina y cafeína: se analizó por HPLC.23 Se utilizó un cromatógrafo líquido (Shimadzu, LC-20AD), equipado con un auto inyector SIL-20A /HT, un módulo de comunicación CBM-20A y un detector con arreglo de fotodiodos (PDA) SPD-M20A, calibrado a 280 nm. La separación de teobromina y cafeína se llevó a cabo en una columna C-18 ultra acuosa cuyas dimensiones eran 5 µm de tamaño de partícula, 250 mm de longitud y 4,6 mm de diámetro. Como fase móvil se utilizó metanol 100 % trabajando en modo isocrático a un flujo de 1,0 mL/min. La identificación de los picos se hizo comparando con estándares de teobromina y cafeína (Sigma-Aldrich®).
Actividad atrapadora del radical libre DPPH: la actividad antioxidante de las muestras se evaluó mediante la capacidad captadora del radical DPPH., utilizando la metodología de Bondet y otros, con algunas modificaciones.24,25 En un tubo de ensayo se adicionaron 10 µL de extracto metánolico o del estándar y 990 µL de una solución de DPPH (20 mg/L) que se preparó con anterioridad en metanol. Como referencia se usó la misma cantidad de DPPH y 10 µL del solvente de la muestra (metanol). Las mezclas se agitaron vigorosamente y se almacenaron a temperatura ambiente y en oscuridad durante 30 min. La absorbancia se registró a 517 nm. Los resultados se expresaron como valores TEAC (µmol de trolox/g de cacao) mediante la construcción de una curva patrón usando varias concentraciones del antioxidante Trolox®.
Medida de la capacidad reductora con el ensayo FRAP: el método consiste en evaluar la capacidad antioxidante de una muestra de acuerdo con su capacidad para reducir el complejo tripiridiltriazina (TPTZ) - Fe3+ hasta su forma ferrosa (Fe2+).26 El reactivo de FRAP se preparó mezclando buffer acetato 0,3 µM (pH 3,6), TPTZ 10 µM (en HCl 40 mM) y FeCl3.6H2O 20 µM en una relación de 10:1:1. En un tubo de ensayo se adicionaron 50 µL del extracto de cacao o ácido ascórbico (estándar), 50 µL de buffer acetato 0,3 µM (pH 3,6) y 900 µL de la solución FRAP. Luego de 30 min de reacción, se registró la absorbancia a 595 nm. Los resultados se expresaron como mg de ácido ascórbico/g de cacao.
Método ORAC: se determinó por la metodología descrita por Ou y otros, con algunas modificaciones.27-29 Se prepararon 3 mL de la siguiente solución: 21 µL de una solución de fluoresceína 10 µM, 2 899 µL de buffer fosfato 75 mM (pH 7,4), 50 µL de AAPH 600 mM y 30 µL de extracto de cacao o Trolox 500 µM (estándar). La fluorescencia se registró cada 60 s a 37 °C, usando un espectrofluorímetro Perkin Elmer LS45, con una multicelda termostatizada. Las lecturas se realizaron a una l de excitación de 493 nm y una l de emisión de 515 nm. El valor ORAC se calculó utilizando la ecuación 2 y los resultados se expresaron como valores TEAC (µmol de trolox/g de cacao).
Donde AUC es el área bajo la curva y f es el factor de dilución de los extractos.29
Evaluación de la capacidad atrapadora de radicales superóxido: en este ensayo se evalúa la capacidad de los antioxidantes para atrapar el radical superóxido, los cuales son generados por el sistema NADH/PMS.30 La reacción se llevó a cabo en buffer fosfato 75 mM, pH 7,4. Las soluciones se adicionaron en las cantidades siguientes: 60 µL de NBT 156 µM, 60 µL de NADH 468 µM, 15 µL de extracto de cacao o catequina (estándar) y finalmente 165 µL de PMS 10 µM. Luego de 5 min de reacción, se registró la absorbancia a 560 nm. Los resultados se reportan como mg de catequina/g de cacao.
Análisis estadístico: los datos se procesaron con un análisis de varianza (ANOVA) y mínima diferencia significante (LDS), con el paquete estadístico SAS 9.2. Las regresiones lineales se hicieron en el paquete estadístico Statgraphics Centurion XV; p< 0,05 se seleccionó como el criterio de diferencias significativas.
RESULTADOS
Contenido de fenoles totales, taninos condensados y antocianinas
En la tabla 1 se muestra el contenido de metabolitos fenólicos en los granos de cacao sometidos al proceso fermentativo. El contenido de fenoles totales varió en un intervalo de 21,69 y 38,64 mg.g-1 en granos sin fermentar, y 22,58 y 50,23 mg.g-1 en granos fermentados. Los clones de cacao que presentaron mayor contenido de fenoles totales fueron ICS 60 y TSH 565 en los granos sin fermentar, e ICS 1 en los granos fermentados. El efecto de la fermentación sobre los clones de cacao no fue uniforme, se observaron cambios positivos y negativos en el contenido de fenoles totales dependiendo de la variedad. El clon CCN 51 no presentó cambios significativos. En ICS 1 e ICS 95, los fenoles totales aumentaron después del procesamiento, mientras que se evidenció una disminución en ICS 60 y TSH 565.
El contenido de taninos condensados arrojó valores entre 32,09 y 77,24 mg.g-1 en granos sin fermentar, y 28,12 y 104,52 mg.g-1 en granos fermentados. Los clones de cacao que presentaron mayor contenido de taninos condensados fueron TSH 565 en los granos sin fermentar, e ICS 1 en los granos fermentados. El efecto de la fermentación sobre el contenido de taninos condensados no fue regular, similar a lo presentado antes en el contenido de fenoles totales. En los clones ICS 1 e ICS 95 hubo un incremento de procianidinas. En CCN 51, ICS 60 y TSH 565 se evidenció una disminución de estos compuestos después de ese procesamiento.
En cuanto al contenido de antocianinas se observa que los valores varían en un intervalo de 0,59 y 1,60 mg.g-1 en granos sin fermentar, así como 0,27 y 1,05 mg.g-1 en granos fermentados. Los clones de cacao que presentaron mayor contenido de antocianinas totales fueron TSH 565 en los granos sin fermentar, e ICS 1 en los granos fermentados. Se observa que el contenido de antocianinas disminuyó después de la fermentación, excepto en el clon ICS 95.
Determinación de (+)-catequina y (-)-epicatequina
El contenido de catequina en los granos de cacao sometidos al proceso de fermentación se muestra en la tabla 1. Los valores varían entre 0,215 y 2,249 mg.g-1 en granos sin fermentar, y 0,023 y 0,672 mg.g-1 en granos fermentados. El clon de cacao que presentó mayor contenido de catequina fue ICS 95 en los granos sin fermentar y CCN 51 en granos fermentados. En cuanto al contenido de epicatequina, resultó mayor que el contenido de catequina para los clones de cacao evaluados, tanto en los granos crudos como fermentados. En la tabla 1 se presenta el contenido de epicatequina de los granos de cacao sometidos al proceso de fermentación. Los valores varían en un intervalo de 3,14 y 10,20 mg.g-1 en granos sin fermentar, y 0,26 y 3,90 mg.g-1 en granos fermentados. Los clones de cacao que presentaron mayor contenido de epicatequina fueron ICS 1 en los granos sin fermentar, e ICS 60 en los granos fermentados. Después de la fermentación se observa un efecto negativo en el contenido de catequina y epicatequina.
Determinación de teobromina y cafeína
En la tabla 2 se presenta el contenido de metilxantinas en los granos de cacao sometidos al proceso fermentativo. El contenido de teobromina varió entre 2,75 y 4,38 mg.g-1 en granos sin fermentar, y 1,24 y 3,32 mg.g-1 en granos fermentados. Los clones de cacao que presentaron mayor contenido de teobromina fueron ICS 60 en los granos sin fermentar, y CCN 51 e ICS 95 en granos fermentados. Se observa que el contenido de teobromina en los granos de cacao disminuyó después de la fermentación. Por otro lado, el contenido de cafeína fue menor con respecto al contenido de teobromina para los clones de cacao evaluados. Los valores varían en un intervalo de 0,43 y 3,54 mg.g-1 en granos sin fermentar, y 0,32 y 1,49 mg.g-1 en granos fermentados. El clon de cacao que presentó mayor contenido de cafeína fue ICS 60 en los granos sin fermentar y fermentados. Después de la fermentación, se evidenció que el contenido de cafeína disminuyó excepto en el clon ICS 95.
Actividad antioxidante
En la tabla 3 se presenta el efecto de la fermentación sobre la actividad antioxidante de los clones de cacao, evaluada por diferentes metodologías. La actividad atrapadora del radical DPPH. varió entre 251,59 y 367,80 µmol Tx.g-1 en los granos sin fermentar, y 253,75 y 464,64 µmol Tx.g-1 en los granos fermentados. Los clones de cacao que presentaron mayor potencial antioxidante por esta metodología fueron ICS 1, ICS 60 y TSH 565 en los granos sin fermentar, e ICS1 en los granos fermentados. Después de la fermentación, se observó un incremento de esta propiedad en los clones ICS 1 e ICS 95.
El poder reductor de los clones de cacao medidos por el método FRAP, varió entre 25,15 y 50,18 mg.g-1 en los granos sin fermentar, y 32,98 y 59,35 mg.g-1 en los granos fermentados. El clon de cacao que presentó mayor poder reductor fue ICS 1 en los granos sin fermentar y fermentados. Después del procesamiento, se evidenció un incremento de esta característica en los clones CCN 51, ICS 1 e ICS 95.
Los valores de la actividad antioxidante evaluada por el método ORAC variaron entre 1 473,22 y 2 873,58 µmol Tx.g-1 en los granos sin fermentar, y 1 410,83 y 2 337,14 µmol Tx.g-1 en los granos fermentados. Los clones de cacao que presentaron mayor potencial antioxidante por esta metodología fueron ICS 60 en los granos sin fermentar, e ICS 1 y TSH 565 en los granos fermentados. Después de la fermentación, se observa un aumento significativo en la actividad antioxidante del clon ICS 1.
La capacidad atrapadora de radicales superóxido arrojó valores entre 8,22 y 31,54 mg.g-1 en los granos sin fermentar, y 6,99 y 25,05 mg.g-1 en los granos fermentados. Los clones de cacao que presentaron mayor capacidad atrapadora de radicales superóxido fueron ICS 95 en los granos sin fermentar, e ICS 1 y ICS 60 en los granos fermentados. La fermentación incrementó la capacidad atrapadora de radicales superóxido de los clones ICS 1 e ICS 60.
No hay un patrón de comportamiento regular en el proceso de fermentación de los granos de los diferentes clones de cacao colombiano. Sin embargo, al correlacionar los cambios en el contenido de fenoles contra los cambios en la actividad antioxidante por la metodología DPPH., para los diversos clones fermentados y sin fermentar, se encuentra que son las únicas variaciones asociadas entre sí y que pueden describir el proceso fermentativo. De tal manera, que la expresión antioxidante de los compuestos fenólicos reductores polares y medianamente polares, que son disueltos en metanol (solvente de la metodología DPPH), están correlacionados con los diversos cambios en el contenido de fenoles totales durante el proceso de fermentación y descritos por la expresión siguiente: DDPPH.= 6,36099*Dfenoles + 5,10923, con r2= 0,982 (Fig.).
DISCUSIÓN
Existen varios factores internos y externos que afectan la calidad o cantidad de los compuestos fenólicos en las plantas, como la diversidad genética (variedad y origen de la muestra), variables ambientales (intensidad de la luz, temperatura, uso de fertilizantes, heridas), procesamiento (fermentación, secado, tostado, alcalinización) y almacenamiento.11,31
El efecto de la fermentación sobre los clones de cacao no fue uniforme, observándose cambios positivos y negativos en los contenidos de los diversos metabolitos secundarios, en dependencia de la variedad. En los clones ICS 1 e ICS 95, los fenoles totales aumentaron después del procesamiento en 42 y 54 %, respectivamente. En ICS 60 y TSH 565, hubo una disminución de 20 y 35 %. Un comportamiento similar se encontró para granos recién cosechados, mostrando que el contenido total de compuestos fenólicos no evolucionó de una forma regular durante este proceso en comparación con los granos fermentados.11 De otro lado, se sugiere que las pérdidas de fenoles totales son debidas a la difusión de los polifenoles fuera de los cotiledones durante la fermentación y puede estimarse como 24 % después de 60 h de fermentación, que alcanza 58 % después de 8 días. Además, los compuestos fenólicos pueden acomplejarse con proteínas, polisacáridos y alcaloides del cacao.32 Por otro lado, el incremento de los polifenoles durante el proceso de fermentación puede reflejar una formación de proantocianidinas poliméricas (taninos).11,32
El contenido de taninos condensados no evolucionó regularmente después del proceso de fermentación. Este comportamiento fue similar al presentado antes en el contenido de fenoles totales. Los clones con un efecto negativo en el contenido de polifenoles durante la fermentación, mostraron una disminución en el contenido de procianidinas. De igual forma, los clones que aumentaron o mantuvieron su contenido de fenoles durante la fermentación, presentaron valores crecientes en el contenido de taninos condensados.33 Se ha encontrado que los niveles de procianidinas disminuyen de 3 a 5 veces durante la fermentación, mostrando una correlación negativa del contenido de procianidinas con el grado de fermentación y el cambio de color púrpura a marrón del grano.34 Este decrecimiento se debe a que los taninos interactúan a través de puentes de hidrógeno con proteínas, produciendo pigmentos marrones insolubles en agua. Por otro lado, el incremento de las procianidinas puede deberse a la interacción entre los polifenoles durante la fermentación.11,32
Por otra parte, las antocianinas son los pigmentos más importantes de las plantas vasculares. Estos pigmentos solubles en agua son responsables del color naranja brillante, rosa, rojo, violeta y azul, en las flores y frutos de algunas plantas. Son muy inestables y sensibles a la degradación. Su estabilidad se ve afectada por varios factores como el pH, temperatura de almacenamiento, productos químicos, estructura, concentración, luz, oxígeno, solventes, presencia de enzimas, flavonoides, proteínas, iones metálicos y tratamiento térmico.35 Durante la fermentación de los granos de cacao, las antocianinas son hidrolizadas por acción de las glicosidasas, que causan el blanqueamiento de los cotiledones. Estas enzimas hidrolizan el enlace glicosídico de las antocianinas y producen azúcar y aglicona, que reduce así el contenido de antocianinas.4
La disminución del contenido de catequina y epicatequina durante la fermentación se debe principalmente a que estos polifenoles son oxidados a quinonas. Las quinonas pueden acomplejarse con aminoácidos, péptidos y proteínas; y polimerizar con otros flavonoides para formar taninos. La reducción también es causada por la difusión de los compuestos fenólicos en los exudados liberados durante este proceso.9,10,32
Las metilxantinas están distribuidas en diferentes partes de la semilla del cacao, en el grano, la pulpa y cubierta. En cuanto al contenido de metilxantinas, los resultados revelan que las diferentes especies de granos de cacao contribuyen a niveles diferentes de teobromina y cafeína, mostrando que el genotipo determina el contenido de alcaloides del cacao. Durante la fermentación, la reducción del contenido de teobromina y cafeína se debe sobre todo a la difusión de estos alcaloides con los líquidos celulares y al genotipo evaluado.23,33 Además, el contenido de cada metilxantina es más alto durante los primeros días de fermentación, y disminuye gradualmente mientras aumenta el tiempo de fermentación.23 Sin embargo, teniendo en cuenta la alta permeabilidad de la cubierta del grano de cacao, Lambert y otros describieron un comportamiento que favorece la acumulación de los alcaloides.36 Además, establecieron que durante los primeros días de fermentación, la estructura del grano de cacao no es afectada y permite que los alcaloides penetren a través de la cubierta, que sean acumulados y, por tanto, aumentar su contenido.37
Cabe resaltar que los diversos granos de los clones de cacao colombiano tienen actividad antioxidante muy superior a la gran mayoría de las frutas y hortalizas reportadas, y expresadas como valores TEAC por los métodos DPPH. y ORAC, y valores AEAC por FRAP; además son grandes atrapadores de los radicales superóxido importantes dentro de muchos procesos fisiológicos.15,38
Los cambios en la composición después de la fermentación, que si bien no son iguales entre clones, explican las transformaciones en el grano responsables de sus propiedades organolépticas finales.
AGRADECIMIENTOS
A la Dirección de Investigaciones (DIME) de la Universidad Nacional de Colombia sede Medellín por el apoyo financiero a través del proyecto 20101007959. Igualmente, se agradece a la Federación Nacional de Cacaoteros (FEDECACAO), por el suministro de las muestras, especialmente al ingeniero Juan Carlos Agudelo.
REFERENCIAS BIBLIOGRÁFICAS
1. Amin I, Zamaliah MM, Chin WF. Total antioxidant activity and phenolic content in selected vegetables. Food Chemistry. 2004;87(4):581-6.
2. Othman A, Ismail A, Ghani NA, Adenan I. Antioxidant capacity and phenolic content of cocoa beans. Food Chemistry. 2007;100(4):1523-30.
3. Jonfia-Essien WA, West G, Alderson PG, Tucker G. Phenolic content and antioxidant capacity of hybrid variety cocoa beans. Food Chemistry. 2008;108(3):1155-9.
4. Wollgast J, Anklam E. Review on polyphenols in Theobroma cacao: Changes in composition during the manufacture of chocolate and methodology for identification and quantification. Food Research International. 2000;33(6):423-47.
5. Cimato A, Mattei A, Osti M. Variation of polyphenol composition with harvesting period. Acta Horticulturae. 1990;286:453-6.
6. Bravo L. Polyphenols: chemistry, dietary sources, metabolism, and nutritional signifcance. Nutrition Reviews. 1998;56(11):317-33.
7. Osman H, Nasarudin R, Lee Sl. Extracts of cocoa (Theobroma cacao L.) leaves and their antioxidation potential. Food Chemistry. 2004;86(1):41-6.
8. Ortega N, Romero MP, Macia A, Reguant J, Angles N, Morello JR, Motilva MJ. Obtention and characterisation of phenolic extracts from different cocoa sources. J Agricultural Food Chemistry. 2008;56(20):9621-7.
9. Forsyth WGC, Quesnel VC. Cacao glycosidase and colour changes during fermentation. J Science Food Agriculture. 1957;8(9):505-9.
10. Kim H, Keeney PG. Epicatechin content in fermented and unfermented cocoa beans. J Food Science. 1984;49(4):1090-2.
11. Niemenak N, Rohsiusb C, Elwersb S, Ndoumoua DO Liebereib R. Comparative study of different cocoa (Theobroma cacao L.) clones in terms of their phenolics and anthocyanins contents. J Food Composition Analysis. 2006;19(6-7):612-9.
12. Keen CL, Holt RR, Oteiza PI, Fraga CG, Schmitz HH. Cocoa antioxidants and cardiovascular health. Am J Clinical Nutr. 2005;81(1):298S-303S.
13. Cherniack EP. Polyphenols: Planting the seeds of treatment for the metabolic syndrome. Nutrition. 2011;27(6):617-23.
14. Jia L, Liu X, Bai YY, Li SH, Sun K, He C, et al. Short-term effect of cocoa product consumption on lipid profile: a meta-analysis of randomized controlled trials. Am J Clin Nutr. 2010;92(1):218-25.
15. Schinella G, Mosca S, Cienfuegos-Jovellanos E, Pasamar MA, Muguerza B, Ramon D, et al. Antioxidant properties of polyphenol-rich cocoa products industrially processed. Food Research International. 2010;43(6):1614-23.
16. Heiss C, Jahn S, Taylor M, Real WM, Angeli F, Wong ML, et al. Improvement of endothelial function with dietary flavanols in associated with mobilization of circulating angiogenic cells in patients with coronary artery disease. J Am College Cardiol. 2010;56(3):218-24.
17. Belšèak A, Komes D, Horžiæ D, Ganiæ KK, Karloviæ D. Comparative study of commercially available cocoa products in terms of their bioactive composition. Food Research International. 2009;42(5-6):707-16.
18. Oliviero T, Capuano E, Cammerer B, Fogliano V. Influence of roasting on the antioxidant activity and HMF formation of a cocoa bean model systems. J Agricultural Food Chemistry. 2009;57(1):147-52.
19. Gu L, House SE, Wu X, Ou B, Prior RL. Procyanidin and catechin contents and antioxidant capacity of cocoa and chocolate products. J Agricultural Food Chemistry. 2006;54(11):4057-61.
20. Singleton Vl, Rossi JA. Colorimetry of total phenolics with phosphomolybdicphosphotungstic acid reagents. Am J Enology Viticulture. 1965;16(3):144-58.
21. Hagerman AE, Riedl KM, Jones GA, Sovi KN, Ritchard NT, Hartzfeld PW, et al. High molecular weight plant polyphenolics (tannins) as biological antioxidants. J Agricultural Food Chemistry. 1998;46(5):1887-92.
22. Gaviria CA, Ochoa CI, Sánchez N, Medina C, Lobo M, Mosquera AJ, et al. Actividad antioxidante e inhibición de la peroxidación lipídica de extractos de frutos de mortiño (Vaccinium meridionale SW). Bol Latinoamericano Caribe Plantas Medicinales y Aromáticas. 2009;8(6):519-28.
23. Brunetto MR, Gutiérrez L, Delgado Y, Gallignani M, Zambrano A, Gómez A, et al. Determination of theobromine, theophylline and caffeine in cocoa samples by a high performance liquid chromatographic method with on-line sample cleanup in a switching-column system. Food Chemistry. 2007;100(2):459-67.
24. Bondet V, Brand-Williams W, Berset C. Kinetic and mechanisms of antioxidant activity using the DPPH free radical method. Food Science Technology- Lebensmittel-Wissenschaft Technologie. 1997;30(6):609-15.
25. Pereañez JA, Lobo Echeverry T, Rojano B, Vargas L, Fernandez M, Gaviria CA, et al. Correlation of the inhibitory activity of phospholipase A2 snake venom and the antioxidant activity of Colombian plant extracts. Rev Bras Farmacogn. 2010;20(6):910-6.
26. Benzie IFF, Strain JJ. The ferric reducing ability of plasma (FRAP) as a measure of «antioxidant power»: The FRAP assay. Analytical Biochemistry. 1996;239(1):70-6.
27. Rojano B, Zapata K, Cortes F. Capacidad atrapadora de radicales libres de Passiflora mollissima (Kunth) L. H. Bailey (curuba). Rev Cubana Plant Med. 2012;17(4):408-19.
28. Naranjo M, Vélez T, Rojano B. Actividad antioxidante de café colombiano de diferentes calidades. Rev Cubana Plant Med. 2011;16(2):164-73.
29. Ou B, Hampsch-Woodill M, Prior R. Development and validation of an improved oxygen radical absorbance capacity assay using fluorescein as the fluorescent probe. J Agricultural Food Chemistry. 2001;49(10):4619-26.
30. Lopera Y, Fantinelli J, Gonzalez LF, Rojano B, Rios JL, Schinella G, et al. Antioxidant activity and cardioprotective effect of a nonalcoholic extract of Vaccinium meridionale Swartz during ischemia-reperfusion in rats. Evidence Based Complementary Alternative Med. 2013;2013:516727. doi: 10.1155/2013/516727. Epub 2013 Feb 6. Available at: http://www.hindawi.com/journals/ecam/2013/516727/abs/
31. Vallejo F, Tomás-Baeberán FA, García-Viguera C. Effect of climatic and sulphur fertilisation conditions, on phenolic compounds and vitamin C, in the inflorescences of eight broccoli cultivars. European Food Research Technology. 2003;216(5):395-401.
32. Forsyth WGC, Quesnel VC, Roberts JB. Interaction of polyphenols and proteins during cacao curing. J Science Food Agriculture. 1958;9(3):181-4.
33. Nazaruddin R, Seng LK, Hassan O, Said M. Effect of pulp preconditioning on the content of polyphenols in cocoa beans (Theobroma cacao) during fermentation. Ind Crops Products. 2006;24(1):87-94.
34. Kealey KS, Snyder RM, Romanczyk LJ, Geyer HM, Myers ME, Withcare EJ, et al. Cocoa components, edible products having enhanced polyphenol content, methods of making same and medical uses. Patent Cooperation Treaty (PCT) WO 98/09533, Mars Incorporated, USA; 1998.
35. Khanal RC, Howard LR, Prior RL. Effect of heating on the stability of grape and blueberry pomace procyanidins and total anthocyanins. Food Research International. 2010;43(5):1464-9.
36. Lambert SV, Aitken WM. Possible influence of cocoa bean testa characteristics on the flavour quality of fermented cocoa beans. 13th international cocoa research conference October 9-14; 2000.
37. Bucheli P, Rousseau G, Alvarez M, Laloi M, McCarthy J. Developmental variation of sugars, carboxylic acids, purine alkaloids, fatty acids, and endoproteinase activity during maturation of Theobroma cacao L. seeds. J Agricultural Food Chemistry. 2001;49(10):5046-51.
38. Contreras-Calderón J, Calderón-Jaimes L, Guerra-Hernández E, García-Villanova B. Antioxidant capacity, phenolic content and vitamin C in pulp, peel and seed from 24 exotic fruits from Colombia. Food Research International. 2011;44(7):2047-53.
Recibido: 11 de agosto de 2013.
Aprobado: 3 de abril de 2013.
Benjamín Alberto Rojano. Laboratorio de Ciencia de Alimentos. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias. A.A 3840, Medellín, Colombia. Teléf.: +57(4) 430 9381; Fax: +57(4) 430 9347. Correo electrónico: brojano@unal.edu.co