ARTÍCULO ORIGINAL
Actividad antinociceptiva y antibacteriana de los alcaloides totales de dos especies de la familia Solanaceae
Antinociceptive and antibacterial activity of total alkaloids from two species of the Solanaceae family
Mg. Marilú Roxana Soto Vásquez
Departamento de Farmacotecnia, Facultad de Farmacia y Bioquímica. Universidad Nacional de Trujillo. Perú.
RESUMEN
Introducción:
Solanum multifidum Lam., y Lycianthes lycioides (L.) Hassl.
son dos especies características de las lomas costeras del Perú.
Ambas pertenecen a la familia Solanaceae, conocida por su elevado contenido
de alcaloides con diversas actividades terapéuticas, lo que motivó
su estudio.
Objetivo:
evaluar la actividad antinociceptiva y antibacteriana de los alcaloides
totales de las hojas de Solanum multifidum Lam., y Lycianthes lycioides
(L.) Hassl.
Métodos:
los alcaloides totales se extrajeron de las hojas secas de las especies
estudiadas, mediante el método descrito por Peña. La actividad antinociceptiva
se evaluó in vivo utilizando el test de las contorciones abdominales,
mientras que la actividad antibacteriana in vitro se evalúo utilizando
la técnica de difusión en agar con discos impregnados y se determinó
la concentración mínima inhibitoria mediante el método de dilución
en agar.
Resultados:
los alcaloides totales de ambas especies presentaron actividad antinociceptiva
a las dosis de 2,5 mg/kg, 5 mg/kg y 10 mg/kg., mostrando mayor porcentaje
de inhibición, a dosis de 10 mg/kg., con diferencias estadísticamente
significativas (p<0,05). Asimismo, estos alcaloides inhibieron el crecimiento
de Staphylococcus aureus (ATCC 25923), Escherichia coli (ATCC
25992), y Pseudomona aeruginosa (ATCC 27853), a las concentraciones
de 2 mg/mL y 4 mg/mL, mostrando mayor bioactividad frente a Staphlylococus
aureus. En términos generales, los alcaloides totales Lycianthes
lycioides (L.) Hassl., resultaron ser más activos como antinociceptivos
y antibacterianos.
Conclusiones:
se demostró la actividad antinociceptiva y antibacteriana de los
alcaloides totales de ambas especies. Este trabajo constituye el primer reporte
de la bioactividad de estas especies vegetales, y resulta una opción
atractiva para el desarrollo de nuevos fármacos.
Palabras clave: alcaloides, Solanum multifidum Lam, Lycianthes lycioides (L.) Hassl., antinociceptiva, antibacteriana.
ABSTRACT
Introduction:
Solanum multifidum Lam. and Lycianthes lycioides (L.) Hassl.
are two species typical of coastal hills of Peru. Both belong to the Solanaceae
family, and are renowned for their high content of alkaloids with a variety
of therapeutic activities. That was the reason why the present study was conducted.
Objective:
evaluate the antinociceptive and antibacterial activity of total alkaloids
from leaves of Solanum multifidum Lam. and Lycianthes lycioides
(L.) Hassl.
Methods:
total alkaloids were extracted from dry leaves of the study species following
the method described by Peña. Antinociceptive activity was evaluated
in vivo using the writhing test, whereas in vitro antibacterial
activity was evaluated with the agar diffusion technique with impregnated
discs. Minimum inhibitory concentration was determined by the agar dilution
method.
Results:
in both species total alkaloids showed antinociceptive activity at doses of
2.5 mg/kg, 5 mg/kg y 10 mg/kg, with the greatest inhibition percentage at
10 mg/kg and statistically significant differences (p<0.05). The alkaloids
also inhibited the growth of Staphylococcus aureus (ATCC 25923), Escherichia
coli (ATCC 25992) and Pseudomona aeruginosa (ATCC 27853) at concentrations
of 2 mg/mL and 4 mg/mL, exhibiting greater bioactivity against Staphlylococus
aureus. In general terms, total alkaloids Lycianthes lycioides
(L.) Hassl. showed the greatest antinociceptive and antibacterial activity.
Conclusions:
it was demonstrated that total alkaloids from both species have antinociceptive
and antibacterial activity. The present paper is the first report about bioactivity
of these plant species, an attractive option for the development of new drugs.
Key words: alkaloids, Solanum multifidum Lam, Lycianthes lycioides (L.) Hassl., antinociceptive, antibacterial.
INTRODUCCIÓN
El dolor es un síntoma, universalmente asociado al padecimiento de una enfermedad, y constituye a menudo la causa que lleva a la persona a buscar ayuda u obtener alivio. Actualmente se ha convertido en una epidemia invisible que afecta al 20 % de la población mundial adulta, influyendo negativamente en la calidad de vida de los pacientes.1
Del mismo modo, las enfermedades infecciosas constituyen un problema de salud pública y son la principal causa de muerte alrededor del mundo. Constantemente los agentes infecciosos superan la barrera de las especies y la resistencia antibiótica y han alcanzado niveles sin precedentes. La humanidad se encuentra ante un panorama de enfermedades emergentes y reemergentes causadas por microorganismos.2,3
Este panorama impulsa al hombre a la búsqueda y descubrimiento de nuevas drogas con eficacia terapéutica que resuelvan los problemas de salud. En este sentido, los productos naturales han desempeñado un papel crucial en el desarrollo de nuevos fármacos; consolidándose en los últimos años, como la fuente principal de más de la mitad de los productos farmacéuticos.4
La familia Solanaceae ha sido usada desde épocas remotas por la humanidad, sea como alimento, medicamento, o con propósitos mágicos y ritualísticos. Solanum multifidun Lam. y Lycianthes lycioides (L.) Hassl., son dos especies vegetales pertenecientes a esta familia. La primera es endémica del Perú, y junto a la segunda constituyen parte de la diversidad vegetal de las lomas costeras.5,6
Numerosos estudios han demostrado que los alcaloides de la familia Solanaceae, exhiben diversas propiedades biológicas, sea el caso de la hiosciamina, atropina y escopolamina, ya usados en medicina. También alcaloides como tomatina, solanina, solasodina, β-solamarina, desacetoxi-solafilidina y 2a-hidroxisoladulcidina, han demostrado poseer propiedades antinociceptivas y antibacterianas frente a bacterias gram positivas y gram negativas.7-11
Basándose en estos estudios se evaluó la actividad antinociceptiva in vivo y la actividad antibacteriana in vitro de los alcaloides de las hojas de Solanum multifidum Lam., y Lycianthes lycioides (L.) Hassl. y de esta manera realizar aportes en relación a las potencialidades terapéuticas de estas especies como nuevos agentes antinociceptivos y antibacterianos, destinados a resolver las problemáticas de salud que la sociedad enfrenta.
MÉTODOS
Material vegetal
Las hojas frescas de las especies de Solanum multifidum Lam. y Lycianthes lycioides (L.) Hassl., fueron recolectadas de las lomas costeras del Cerro Campana en el área comprendida entre las coordenadas geográficas: 8° 00’ 18.16” latitud sur - 79° 06´18.34” longitud oeste y los 7° 58’ 36.98” latitud sur - 79° 06´16.18” longitud oeste, a una altitud entre los 244 y 700 m.s.n.m. del distrito de Huanchaco, provincia de Trujillo, región La Libertad, durante el mes de octubre. Estas especies fueron identificadas por el biólogo-botánico Eric Frank Rodríguez Rodríguez, curador del Herbarium Truxillense (HUT) de la Universidad Nacional de Trujillo, y depositadas en el herbario con los códigos: N° 50979 y N° 50976.
Extracción de los alcaloides totales
Para la extracción de los alcaloides totales (AT) se utilizó la metodología descrita por Peña.12
Las hojas de las especies en estudio fueron seleccionadas, lavadas y desecadas en la estufa a 40 °C por 5 días, luego fueron pulverizadas en un mortero y tamizadas por un tamiz de malla N° 20.
Una vez tamizadas las muestras se pesaron 50 g de cada una de ellas y se hidrataron con 50 mL de agua destilada durante una hora. Luego se agregaron 200 mL de la mezcla extractora Etanol: Cloroformo (2:1 v/v) y se agitaron durante 2 horas a baja velocidad. Al cabo de ese tiempo se filtró la mezcla en un embudo de Büchner al vacío con papel de filtro Whatman #40 y el residuose extrajo nuevamente con 200 mL de mezcla extractora por dos veces más. En cada filtrada se lavó el agitador y los filtros con la mezcla etanol/cloroformo restante.
La solución filtrada se colocó en un rota vapor marca HEIDOLPH a 60 °C y 500 mm Hg de presión y se concentró hasta un volumen de aproximadamente 20 mL. Luego se transfirió a una pera de decantación donde se agregaron 10 mL de solución de ácido acético (agua: ácido acético glacial, 98:2, v/v) y 10 mL de éter de petróleo. Se agitó vigorosamente y se lavó varias veces con el éter de petróleo hasta que no se evidenciara la coloración verde característica de la clorofila.
Luego se separó y se filtró la fase acuosa con papel de filtro Whatman #40. Se tomó una alícuota de esta solución y se comprobó la presencia de alcaloides con los reactivos de Dragendorff, Mayer, Wagner y Hager.
La fase acuosa ácida filtrada, se colocó en un erlenmeyer de 100 mL donde se le adicionó gota a gota hidróxido de amonio concentrado hasta un pH de 9 y luego se llevó a baño María marca Memmert a 85 °C por 10 minutos y se enfrió a 5 °C por 30 minutos, donde los alcaloides son floculados. Se centrifugó el contenido del erlenmeyer a 3,000 rpm por 40 minutos. El sobrenadante fue descartado y el precipitado (alcaloides totales) obtenido fue secado a estufa a 40 °C y guardado en un frasco de vidrio de color ámbar para su posterior utilización.
Actividad antinociceptiva in vivo
Animales
Para el estudio de la actividad antinociceptiva in vivo se utilizaron 80 especímenes de ratones de la cepa BALB/c (Mus musculus) machos, con un peso entre 25-35 g. Los animales fueron asignados al azar, distribuidos en 08 grupos de 10 animales. Estos se mantuvieron con dieta comercial y agua ad libitum. Estuvieron colocados en un ambiente climatizado de 22 ± 1 °C y, fueron mantenidas en un ciclo de 12 h de luz y oscuridad. Todas las experiencias se iniciaron a las 9 a.m. Se trabajó bajo las recomendaciones internacionales de la Declaración de la Asociación Médica Mundial sobre el Uso de Animales en la Investigación Biomédica.13
Test de contorciones abdominales inducidas por ácido acético (writhing test).
La prueba nociceptiva utilizada fue una modificación de la prueba de contorciones abdominales.14 Cada animal recibió una inyección, vía intraperitoneal (i.p.), de 0,1 mL /10g de peso, de ácido acético al 1 % en suero fisiológico. Los animales fueron colocados, por separado, en jaulas metálicas para observar y contar el número de contorciones abdominales.
Diseño experimental
Grupo N° 01 (Control), se les administró ácido acético al 1 %, vía i.p., a dosis de 0,1 mL/10 g de peso.
Grupo No 02, 03 y 04 (Problemas), se les administró alcaloides totales de las hojas Solanum multifidum Lam. a las dosis de 2,5 mg/kg, 5 mg/kg, 10 mg/kg de peso, vía oral, y 60 minutos después se aplicó ácido acético al 1 %, vía i.p.
Grupo No 05, 06 y 07 (Problemas), se les administró alcaloides totales de las hojas de Lycianthes lycioides (L.) Hassl. a las dosis de 2,5 mg/kg, 5 mg/kg y 10 mg/kg de peso, vía oral, y 60 minutos después se administró ácido acético al 1 %, vía i.p.
Grupo No 08 (Patrón), se le administró indometacina 10 mg/kg i.p. y 60 minutos después se administró ácido acético al 1 %, vía i.p.
Luego se controló el número de contorciones en intervalos de 5 minutos durante 20 minutos. Se calculó el porcentaje de eficacia analgésica con la siguiente fórmula:
% A = X control – X muestra x 100
X control
Dónde: A % = porcentaje de inhibición de contorsiones
X control = media aritmética del número de contorsiones con el ácido acético
X muestra = media aritmética del número de contorsiones con la muestra.
Evaluación de la actividad antibacteriana in vitro
Se empleó la técnica de difusión en agar con discos impregnados, basada en el método de Kirby- Bauer modificado.15-17
Microorganismos
Se trabajó con tres cepas bacterianas patógenas tipificadas, bacteria Gram positiva Staphylococcus aureus (ATCC 25923); y dos bacterias Gram negativas: Escherichia coli (ATCC 25992) y Pseudomonas aeruginosa (ATCC 27853), las cuales fueron proporcionadas por el Laboratorio de Microbiología del Hospital de Belén.
Preparación de la muestra
Se prepararon concentraciones de 2 mg/mL y 4 mg/mL de alcaloides totales (AT) de S. multifidum Lam y L. lycoides (L) disueltos en dimetilsulfóxido (DMSO).
Reactivación de las cepas
Las bacterias fueron reactivadas en caldo Müeller Hinton (CMH) y se incubaron durante 18 horas a 37 °C. Luego se tomó una asada de cada bacteria y se ajustó con solución salina fisiológica al Patrón de Turbidez de Mac Farland N° 0.5 (108 UFC/mL).
Sembrado
Se colocaron en 18 placas de Petri, 20 mL de Agar Müeller-Hinton (AMH). Solidificado cada agar, se sembraron sobre la superficie de cada 6 placas de Petri las bacterias de Staphylococcus aureus (ATCC 25923), Escherichia coli (ATCC 25992) y Pseudomonas aeruginosa (ATCC 27853) respectivamente. Se hisoparon uniformemente, girando cada placa 30 grados por 10 veces aproximadamente. Las placas recién sembradas fueron colocadas en una estufa a 37 °C de temperatura durante 10 minutos.
Aplicación de los discos
Se tomaron 9 placas para cada especie vegetal, 3 placas por cada microorganismo respectivo. Sobre estas placas sembradas, se colocaron en la superficie del agar inoculado, los discos estériles de 6 mm de diámetro de papel filtro Whatman #1, impregnados con 10 µL de cada uno de los alcaloides totales disueltos en DMSO, a las concentraciones de 2 y 4 mg/mL. Además, se colocó como control negativo un disco de papel Whatman #1, con 10 µL de DMSO y, como control positivo se usó cloranfenicol en concentración de 100 μg/mL (10 μL/disco).
Luego, las placas de Petri se incubaron a 37 °C por 24 h. Se determinaron los diámetros de halos de inhibición de los alcaloides totales frente a los microorganismos en estudio. Finalmente, se calculó el porcentaje de inhibición mediante la fórmula siguiente:
% Inhibición = Diámetro de la muestra (mm) – Diámetro del blanco x 100
Diámetro del control (mm) – Diámetro del blanco
Diámetro de la muestra = Halo de inhibición de los alcaloides totales en mm
Diámetro del blanco= Halo de inhibición de DMSO en mm
Diámetro del control = Halo de inhibición de cloranfenicol en mm
Determinación de la concentración mínima inhibitoria (CMI)
Método de dilución en agar
En este método se incorpora el producto a evaluar y los microorganismos en un medio con agar cuando este aún esta líquido. Utilizando microplacas de fondo plano de 24 pozos se añaden determinadas concentraciones del producto, que luego son incubadas por 24 horas, examinándose después el crecimiento o no crecimiento del microorganismo para determinar la concentración mínima inhibitoria.18
Preparación de la muestra
Se prepararon concentraciones de 1 mg/mL; 0,75 mg/mL; 0,50 mg/mL; 0,25 mg/mL; 0,1 mg/mL; 0,05 mg/mL. de alcaloides totales de S. multifidum Lam y L. lycoides (L) disueltos en dimetilsulfóxido (DMSO).
Reactivación de las cepas
Las bacterias fueron reactivadas en CMH y se incubaron durante 18 horas a 37 °C. Luego se tomó una asada de cada bacteria y se ajustó con solución salina fisiológica al Patrón de Turbidez de Mac Farland N° 0.5 (108 UFC/mL).
Enfrentamiento con los microorganismos
Se utilizó microplacas de fondo plano de 24 pozos, en las cuales se colocaron 1 mL de agar AMH y cuando el medio aún estaba líquido se añadió 10 µL de cada una de las concentraciones de los alcaloides totales preparados anteriormente, luego en cada pozo se colocó 2 µL de la suspensión del inóculo de cada bacteria y se incubó a 37 °C por 24 horas.
Se empleó como control negativo DMSO y como control positivo cloranfenicol a una concentración de 100 μg/mL. y se trabajó bajo las condiciones anteriormente descritas.
Después de 24 horas de incubación a 37 °C, las microplacas se examinaron visualmente. El punto final (Concentración Mínima Inhibitoria) se consideró a la menor concentración de compuesto frente a la cual el microorganismo ensayado no presentó desarrollo visible. Todos los ensayos se realizaron por triplicado.18
Análisis estadístico
Los resultados fueron procesados utilizandoel programa estadístico SPSS v. 18.0 y expresados como mediana aritmética ± desviación estándar. Se determinó la relación entre los grupos mediante el test de ANOVA de una vía, donde p<0,05 fue considerado como estadísticamente significativo.
RESULTADOS
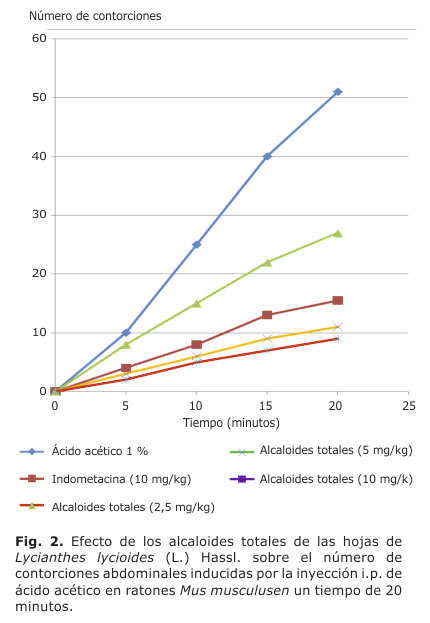
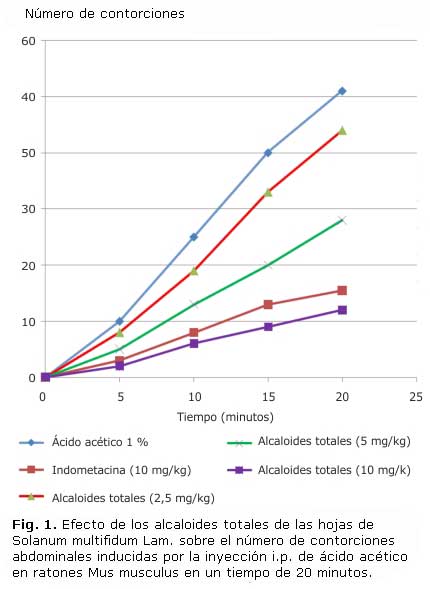
En la tabla 1, se observa el efecto antinociceptivo in vivo de los alcaloides totales de las hojas de S. multifidum Lam.y L. lycioides (L.) Hassl., a diferentes dosis (2,5 mg/kg, 5 mg/kg y 10 mg/kg), notándose que a mayor dosis, mayor es el efecto antinociceptivo; como es el caso de la dosis de 10 mg/kg, donde los AT de la especie de L. lycioides (L.) Hassl., presentaron mayor porcentaje de inhibición de contorciones (82,3 %), seguido de los alcaloides totales de S. multifidum Lam. (76,5 %); obteniendo la indometacina un porcentaje de inhibición de contorciones de 69,9 %. Lo que indica que los alcaloides de ambas especies poseen mayor efecto antinociceptivo, en comparación con el fármaco patrón. Estos resultados son estadísticamente significativos (p< 0,05) respecto al control según análisis ANOVA.Asimismo se observa en las figuras 1 y 2, que los alcaloides totales de ambas especies de estudio, a las dosis de 2,5 mg/kg, 5 mg/kg y 10 mg/kg, disminuyeron el número de contorciones abdominales inducidas por ácido acético intraperitoneal en los ratones, durante 20 minutos; siendo la dosis 10 mg/kg, la que disminuyó más el número de contorsiones abdominales, en comparación con la indometacina. Los resultados mostraron diferencias estadísticamente significativas (p<0,05) respecto al control según análisis ANOVA.
En lo que respecta a la actividad antibacteriana in vitro, según la tabla 2, los alcaloides totales de ambas especies, a las concentraciones de 2 mg/mL y 4 mg/mL, inhibieron el desarrollo del crecimiento de las tres cepas ensayadas: Staphylococcus aureus (ATCC 25923), Escherichia coli (ATCC 25992), Pseudomonas aeruginosa (ATCC 27853). Los AT de las hojas de ambas especies, mostraron mayores porcentajes de inhibición frente a Staphylococcus aureus (ATCC 25923) a la concentración de 4 mg/mL con 68,3 % y 87,8 % respectivamente.
Según la tabla 3, las CMI de los AT de las hojas de S. multifidum Lam. y L. lycioides (L.) fueron de 0,25 mg/mL y 0,1 mg/mL para a S. aureus; 0,75 mg/mL y 0,5 mg/mL para E.coli, y 0,5 mg/mL y 0,25 mg/mL para P. aeruginosa respectivamente.
DISCUSIÓN